
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Свойства коллоидных систем
1) Молекулярно-кинетические свойства коллоидных систем (связаны с движением частиц).
а) Свойства, связанные с тепловым движением частиц – броуновское движение, диффузия, осмотическое давление, температуры замерзания, кипения и др. –
б) Седиментация – оседание коллоидных частиц под действием силы тяжести. Седиментационное равновесие используется в диагностике, например, определение СОЭ –
2) Оптические свойства коллоидных систем (Закон Рэлея).
Путь светового луча, проходящего через прозрачный коллоидный раствор, на темном поле, становится видимым – наблюдается конус Тиндаля. При пропускании света через истинные растворы конус Тиндаля не наблюдается – они прозрачные. При пропускании света через взвесь частицы отражают свет, наблюдается освещенность всего раствора, и они выглядят мутными.
Кроме того, окраска бесцветного золя зависит от освещения: в отраженном свете сине-голубой цвет, в проходящем свете – желто-красный. Наблюдается опалесценция (переливчатое свечение).
Использование оптических свойств коллоидных систем: нефелометрия - измерение концентрации по рассеянию света опалесцирующими растворами, турбодиметрия - измерение концентрации по мутности, ультрамикроскопия – изучение концентрации, формы и размеров частиц.
3) Электрокинетические свойства коллоидных систем.
Электрофорез – движение заряженных частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля.
Электроосмос – движение дисперсионной среды относительно дисперсной фазы под действием внешнего электрического поля.
4) Устойчивость коллоидных растворов (метод. рук-во, стр. 167-168)
а) седиментационная (молекулярно-кинетическая) устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
б) агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять свои размеры.
Коагуляция - нарушение агрегативной устойчивости, процесс укрупнения частиц (лат. coagulatio – свертывание, сгущение). Две стадии коагуляции:
скрытая коагуляция, она не сопровождается внешним изменением системы. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
явная коагуляции - наблюдается изменение окраски, помутнение, агрегаты частиц всплывают или выпадают в осадок, вследствие седиментации. Частицы становятся крупными и не участвуют в броуновском движении.
Коагуляция может происходить самопроизвольно (старение), но чаще всего она вызвана внешними признаками.
Причины коагуляции:
1. повышение концентрации золя,
2. изменение температуры,
3. механическое воздействие,
4. облучение,
5. длительный диализ или ультрафильтрация,
6. действие электролитов, неэлектролитов,
7. смешение двух золей с различными знаками заряда
8. действие электрического или электромагнитного поля.
Порог коагуляции – минимальная концентрация электролита, при которой наступает коагуляция. Сп или γ
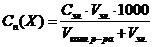 , где
, где
Cп(Х) – порог коагуляции, ммоль/л (миллимоль электролита на 1л золя).
Сэл – исходная концентрация, моль/л;
Vэл – наименьший объем раствора электролита, вызывающий коагуляцию, л;
Vколл.р-ра – объем коллоидного раствора, л.
Коагулирующая способность – К.С.  (л/моль).
(л/моль).
1. Правило Шульце – Гарди: Коагулирующим действием обладает не весь электролит, а тот ион, заряд которого противоположен заряду коллоидной частицы (гранулы) или совпадает с зарядом противоионов. Этот ион называют ионом-коагулянтом. Коагулирующее способность ионов-коагулянтов растет с увеличением заряда ионов: пропорционально шестой степени заряда иона. К.С. = f(z6).
3. При коагуляции электролитами возможны процессы:
Не нашли, что искали? Воспользуйтесь поиском: