
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Примеры решения задач. Какой из следующих процессов протекает при электролизе водного раствора NaI на графитовом аноде?
Задача 1.
Какой из следующих процессов протекает при электролизе водного раствора NaI на графитовом аноде?
а) Na – e- = Na+; б) 2I– – 2e- = I2;
в) 4OH– – 4e- = 2H2O + O2; г) 2H2O – 4e- = O2 + 4H+;.
Решение:
При электролизе водных растворов солей на аноде возможны два процесса окисления:
1. процесс окисления анионов соли (кислотного остатка):
2I– – 2e- = I2
2. процесс электрохимического окисления молекул воды:
2H2O – 4e- = O2 + 4H+.
В данном случае на аноде будут окисляться анионы хлора, т.к. для электрохимического окисления воды необходима большая положительная поляризация анода.
Ответ: 2I– – 2e- = I2
Задача 2.
Какое вещество и в каком количестве выделится на катоде при электролизе раствора Hg(NO3)2 (анод графитовый) в течение 10 минут при силе тока 8А?
Решение:
При электролизе водных растворов солей на катоде возможно протекание двух восстановительных процессов. Один из них – восстановление катионов металла:
Hg2+ + 2e- = Hg.
Другой возможный процесс – восстановление водорода из молекул воды:
2H2O + 2e- = H2 + 2OH–.
В данном случае на катоде будут восстанавливаться катионы ртути, т.к. этот металл входит в группу малоактивных металлов, и для его восстановления необходима меньшая отрицательная поляризация электрода, чем для восстановления водорода.
На катоде: Hg2+ + 2e- = Hg;
Количество выделившейся ртути, согласно законам Фарадея, равно:
mHg = 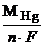 I t (сек)=
I t (сек)=  × 8 × 600 = 5 г.
× 8 × 600 = 5 г.
КОНТРОЛЬНЫЕ ВОПРОСЫ
211. Составьте схему электролиза раствора сульфата меди (анод медный и графитовый). В ответе укажите вещества, выделившиеся на катоде и аноде.
212. Сколько граммов меди выделится на катоде при электролизе раствора CuCl2 (анод инертный) в течение 40 минут при силе тока 1,2 А. Составьте схему электролиза.
213. Составьте схему электролиза раствора нитрата калия (анод-инертный). В ответе укажите вещества, выделившиеся на катоде и аноде.
214. Сколько граммов cеребра выделится на катоде при электролизе раствора AgNO3 (анод инертный) при силе тока 8 А в течение 15 минут? Составьте схему электролиза.
215. Найдите объем водорода (н.у.), который выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор H2SO4. Составьте схему электролиза этого раствора.
216. Сколько литров водорода выделится на катоде при электролизе раствора MgCl2 (анод инертный) в течение 30 минут при силе тока 1,5 А. Составьте схему электролиза.
217. Электролиз раствора NaI (анод графитовый) проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу веществ, выделившихся на катоде и на аноде.
218. Составьте схему электролиза раствора и расплава хлорида кальция (анод-инертный). В ответе укажите вещества, выделившиеся на катоде и аноде.
218. Сколько литров кислорода выделится на катоде при электролизе раствора NiSO4 (анод угольный) в течение 20 минут при силе тока 2,5 А. Составьте схему электролиза.
219. Составьте схему электролиза раствора и расплава хлорида калия (анод-графитовый). В ответе укажите вещества, выделившиеся на катоде и аноде.
220. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора CuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.).
221. Составьте схему электролиза раствора хлорида никеля (анод-никелевый и графитовый).
222. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора CdCl2. Вычислите массу кадмия, выделившегося на катоде, если на аноде выделилось 280 мл газа (н.у.).
223. Составьте схему электролиза раствора нитрата свинца (анод графитовый и свинцовый).
224. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплава MgCl2. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 48250 Кл электричества через этот расплав.
225. Составьте схему электролиза раствора нитрата ртути (анод графитовый).
226. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KOH. Вычислите объем кислорода (н.у.), который выделится при пропускании через этот раствор тока силой в 3 А в течение 1 часа.
227. Составьте схемы электролиза растворов нитрата свинца и хлорида свинца (анод свинцовый).
228. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KI. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 10 F электричества через этот раствор.
229. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KI. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 10 F электричества через этот раствор.
230. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора АgNO3. Вычислите массы веществ, выделившихся на катоде и на аноде при пропускании 2 F электричества через этот раствор.
231. Составьте схемы электролиза растворов хлорида и сульфата никеля (анод-никелевый и графитовый).
232. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора CdCl2. Вычислите массу кадмия, выделившегося на катоде, если на аноде выделилось 280 мл газа (н.у.).
233. Электролиз раствора сульфата цинка проводили в течение 5 часов, в результате чего выделилось 6 л (н.у.) кислорода. Составьте уравнения электродных процессов и вычислите силу тока.
234. Электролиз сульфата меди проводили с медным анодом в течение 4 часов при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте уравнения электродных процессов, происходящих на электродах в случае медного и угольного анода.
235. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплава и водного растворов КОН. Сколько литров (н.у.) газа выделится на аноде, если электролиз проводить в течение 30 мин. при силе тока 0,5 А?
236. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КBr. Какая масса вещества выделится на катоде и аноде, если электролиз проводить в течение 1 ч. 30 мин. при силе тока 15 А?
237. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора NaОН. Чему равна сила тока, если в течение 1ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде?
238. При электролизе расплава хлорида калия на катоде получили калий массой 7,8 г. Определите объем газа (н.у.), который выделился на аноде. Составьте уравнения электродных процессов, происходящих на электродах.
239. При рафинировании меди ток силой 50 А выделяет за 10 ч 550 г меди. Определите выход меди по току.
240. Вычислите время, необходимое для выделения железа массой 2,8 г из раствора сульфата железа (II) если через него пропускать ток силой в 10 А. Составьте уравнения электродных процессов, происходящих на графитовых электродах при электролизе раствора FeSO4.
Коррозия металлов
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. В результате постепенного разрушения металла механические свойства и внешний вид предмета заметно ухудшаются, и он рано или поздно приходит в негодность. Образование ржавчины – частный случай коррозии, то есть разрушение металлов под действием окружающей среды. Во всех случаях металлы при коррозии превращаются в соединения, где они проявляют положительную степень окисления, поэтому любая коррозия – это окисление металла. Различают два основных вида коррозии – химическую и электрохимическую.
Химическая коррозия происходит при взаимодествии металлов с сухими газами или жидкостями-неэлектролитами (бензином, маслом). Большой вред наносит газовая коррозия – окисление металлов кислородом воздуха, сернистым газом, галогенами. От газовой коррозии разрушаются многие детали инженерных конструкций – турбины, корпусы автомобилей и кораблей, сопла ракетных двигателей и т.д. Скорость коррозии заметно увеличивается при нагревании.
Электрохимическая коррозия металлов происходит под действием растворов электролитов, которое сопровождается возникновением электрического тока. Электролитом может служить морская вода, речная вода, конденсированная влага, растворы солей кислот, щелочей. Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие – роль катода (принимают электроны). На аноде (более активном металле) идет окисление атомов металла.
 |
Рис. 8.1 Основная схема электрохимической коррозии
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
Анодный –окисление металла А:Me0 – ne– =Men+
И катодный – восстановление ионов водорода или молекул кислорода, растворенного в воде, К: 2H+ + 2e– =H2
K: O2 + 2H2O + 4e– =4OH–.
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами.
Не нашли, что искали? Воспользуйтесь поиском: