
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Водородный и гидроксильный показатели. Гидролиз солей.
Электростатическое взаимодействие полярных молекул воды приводит к их самоионизации (автопротолизу): Н2О + Н2О «Н3О+ + ОН-. Протоны пере-мещаются от одних молекул воды к другим: Н+ + Н2О «Н3О+. В упрощенной форме диссоциацию воды записывают в виде: Н2О «Н+ + ОН-. При 25°С: [Н+].[ОН-] = 1.10-14, в чистой воде [Н+] = [ОН-] = 1.10-7 моль/л.
В логарифмической форме: pH + pOH = 14, в чистой воде: pH = pOH = 7, где pH = - lg [H+], pOH = - lg [OH-], а [H+] - молярная концентрация ионов H+,
[OH- ] – молярная концентрация ионов ОН-.
В растворе одноосновной сильной кислоты HAn (a = 1):
HAn ® H+ + An-
[H+] = C(HАn); pH = - lg C(HАn)
В растворе однокислотного сильного основания KtOH (a = 1):
KtOH ® Kt+ + OH-
[OH-] = C(KtOH); pOH = - lg C(KtOH)
pH = 14 - pOH = 14 + lg C(KtOH).
В растворе одноосновной слабой кислоты: [H+] = C . a =  ;
;
pH= - lg C.a = - lg 
В растворе однокислотного слабого основания: [OH-]= С.a =  ;
;
pOH = - lg C.a= - lg 
pH = 14 - pOH = 14 + lg C.a = 14 + lg 
Если при растворении в воде соли образуется слабый электролит (слабая кислота, слабое основание или и то, и другое), то наблюдается ионный гидролиз, в результате которого равновесие Н2О «Н+ + ОН- смещается вправо. В растворе соли накапливаются ионы Н+ ([Н+] > [ОН-] – среда кислая) или ионы ОН– ([Н+] < [ОН-] - среда щелочная).
В логарифмической форме: pH < 7 - кислая среда, pH > 7 - щелочная среда.
Количественно процесс гидролиза характеризуется константой гидролиза (Kгидр.) и степенью гидролиза (h): Kгидр. =  . При 1 - h» 1, Kгидр. = h2. C.
. При 1 - h» 1, Kгидр. = h2. C.
В случае гидролиза соли, образованной сильным основанием и слабой кислотой: Kгидр. = 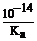 .
.
В случае гидролиза соли, образованной слабым основанием и сильной кислотой: Kгидр. =  .
.
В случае гидролиза соли, образованной слабым основанием и слабой
кислотой: K гидр. =  .
.
Задачи с решениями.
1. Вычислите pH и pOH 0,01 М раствора HCl, если a = 80 %.
| Дано: C(HCl) = 0,01моль/л a = 80 % = 0,8 pH =? pOH =? | Решение: HCl «H+ + Cl- [H+] = C(HCl). a; pH = -lg [H+], pOH = 14 - pH 1) [H+] = 0,01.0,8 = 8.10-3 (моль/л) 2) pH = - lg 8.10-3 = 3 - lg 8 = 3 - 0,9 = 2,1 3) pOH = 14 - 2,1 = 11,9 |
Ответ: pH = 2,1; pОH = 11,9.
2. Вычислите рН 0,001 М раствора СНСООН, зная что Ка = 1,8 . 10-5.
| Дано: С(СН3СООН)=1.10-3 моль/л Ка = 1,8.10 - 5 рН =? | Решение:
СН3 СООН «СН3 СОО- + Н+
рН = - lg [Н+]
[H+] = 
|
1) [Н+] = 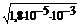 = 1,35 . 10-4 (моль/л)
= 1,35 . 10-4 (моль/л)
2) рН = -lg 1,35 . 10-4 = 4 - 0,13 = 3,87
Ответ: рН = 3,87
3. Вычислите рН раствора, содержащего 0,4 г NaOH в 2 л раствора (a= 100%).
| Дано: m(NaOH) = 0,4 г V(p-pa) = 2 л a = 100% = 1 pH =? | Решение: NaOH «Na+ + OH-
pH = 14 - pOH; pOH = - lg [OH-];
[OH-] = C(NaOH) =  1) C(NaOH) =
1) C(NaOH) =  = 0,005 (моль/л) = 0,005 (моль/л)
|
2) [OH-] = 0,005 моль/л
3) pOH = - lg 5 . 10-3 = 3 - lg 5 = 3 - 0,7 = 2,3
4) pH = 14 - 2,3 = 11,7
Ответ: рН = 11,7
4. Вычислите рН 0,1 М раствора NH3, зная что Kb = 1,8 . 10-5.
 Дано:
С(NH3) = 0,1 моль/л
Kb = 1,8.10 –5
рН =? Дано:
С(NH3) = 0,1 моль/л
Kb = 1,8.10 –5
рН =?
| Решение:
NH3 + H2 O «NH4+ + OH-
pH = 14 - pOH, рOH = - lg [OH-]
[OH-] = 
|
1) [OH-] =  = 1,35 . 10–3 (моль/л)
= 1,35 . 10–3 (моль/л)
2) pOH = 3 - lg 1,35 = 3 - 0,13 = 2,87
3) pH = 14 - 2,87 = 11,13
Ответ: pH = 11,13
5. Запишите уравнения гидролиза солей: Na3PO4, Na2HPO4, NaH2PO4. Вычислите константы гидролиза этих солей. Какая соль гидролизуется в большей степени? Kа1 = 7,1 . 10-3, Kа2 = 6,2 . 10-8, Kа3 = 5,0. 10 -13.
Решение:
1) Na3PO4 + H2O «Na2HPO4 + NaOH;  + H2O «
+ H2O « + OH-
+ OH-
Kгидр.1 =  = 2 . 10–2
= 2 . 10–2
2) Na2HPO4 + H2O «NaH2PO4 + NaOH,  + H2O «
+ H2O « + OH-
+ OH-
Kгидр.2 =  = 1,6 . 10-7
= 1,6 . 10-7
3) NaH2PO4 + H2 O «H3PO4 +NaOH,  + H2O «H3PO4 + OH-
+ H2O «H3PO4 + OH-
Kгидр.3 = 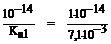 = 1,4 . 10–18
= 1,4 . 10–18
Ответ: Na3PO4 гидролизуется в большей степени.
Вопросы и задачи для самоподготовки.
1. Что называют ионным произведением воды? В каком соотношении находится эта величина с константой воды?
2. Как определяется числовое значение ионного произведения воды? Зависит ли оно от температуры?
3. Как, зная концентрацию ионов Н+ (ОН-), определить концентрацию ионов ОН- (Н+)?
4. Правильно ли утверждение, что в растворе сильной кислоты (щёлочи) содержатся ионы ОН- (Н+ )? Ответ мотивируете?
5. Как связана концентрация ионов Н+ (ОН-) в растворах сильных и слабых кислот и оснований с их молярной концентрацией?
6. Что называют водородным показателем (рН), гидроксильным показателем (рОН)? Чему равна их сумма?
7. Какие значения имеют концентрации ионов Н+ (ОН-) и рН (рОН) в различных средах?
8. При одинаковой молярной концентрации растворы каких электролитов будут иметь меньшее значение рН: а) HCl или CH3COOH; б)HNO2 или HClO; в) HCl или KOH?
9. Что называют гидролизом? Что понимают под гидролизом: а) ковалентным и ионным; б) по катиону, по аниону; в) простым и ступенчатым; г) обратимым и необратимым? Приведите примеры.
10. Как влияет на состояние равновесия Н2О «Н+ + ОН- и значение рН добавление гидролизующейся соли на примерах ZnCl2, K2CO3, Al2S3?
11. Для какой соли рН раствора будет иметь большее значение: а)NaNO3 или NaNO2; б) CH3 COOK или CH3COONH4; в) KClO или KClO3?
12. Можно ли при помощи кислотно-основного индикатора отличить друг от друга растворы солей:
а) NaClO4 и NaClO; б) KI и NH4I; в) KClO3 и KCl,
г) Na2CO3 и Zn(NO3)2; д) BeCl2 и BaCl2; е) MgSO4 и K2SO4?
13. Что называют гидролитическим равновесием?
14. Что называют степенью и константой гидролиза? Зависят ли они от природы соли, концентрации раствора, температуры?
15. Какой формулой выражают соотношение между константой и степенью гидролиза?
16. Как константа гидролиза связана с константой диссоциации слабого электролита?
17. Какая из двух солей гидролизуется в большей степени: а) KCN или KSCN (K(HCN) = 7,9 . 10-10, K(HSCN) = 1,4 . 10-1); б) Na2S или NaHS (K1а = 6 . 10-8 , K2а = 1 . 10-14)? Ответ подтвердите расчетом.
18. Как объяснить взаимоусиление гидролиза двух солей при смешивании их растворов? В каких случаях наблюдается это явление?
19. Вычислите рН 0,05 %-ного раствора HNO3, зная, что r(р-pа) = 1г/мл, a(HNO3) = 100%. Ответ: 2,1.
20. Рассчитайте молярную концентрацию раствора СН3СООН, рН которого равен 3. Kа = 1,75 . 10-5. Ответ: 0,057 моль/л.
21. Вычислите рН раствора, полученного разбавлением водой 0,01 л 30 %-ного раствора NaOH (r = 1,328 г/мл) до 0,75 л. a = 70%.
Ответ: 12,97.
22. Определите рН раствора, в 3 л которого содержится 8,1 . 10-4 моль ионов ОН-. Ответ: 10,43.
23. Рассчитайте рН раствора, в 0,4 л которого содержится 0,39 моль NH3, если Kb = 1,77 . 10-5. Ответ: 11,1.
24. Какое значение рН имеют растворы HCN, если: а) a = 0,0265%; б) a = 0,0084%? K(HCN) = 7,9 . 10-10. Ответ: 6,53; 5,03.
25. Степень диссоциации слабой одноосновной кислоты в 0,2 N растворе равна 0,03. Вычислите значения [Н+] и рОН этого раствора.
Ответ: [Н+] = 6,0 . 10–3 моль/л; рОН = 11,96.
26. Рассчитайте рН раствора, полученного смешением 25 мл 0,5 М раствора HCl, 10 мл 0,5 М раствора NaOH и 15 мл воды (a = 1). Ответ: 0,82.
27. Каким значением рН характеризуется раствор СН3СООН (r = 1 г/мл), в котором её массовая доля составляет 0,6 %? Сколько воды надо прибавить к этому раствору объёмом 1 л, чтобы значение рН стало равным 3. Kа = 1,75 . 10-5
Ответ: 3,49; 0,8 л.
28. Рассчитайте константу гидролиза NH4Cl, зная, что Кb = 1,77 . 10-5.
Ответ: 5,65 . 10-10.
29. Рассчитайте константы гидролиза следующих солей: HCOONa, HCOONH4, NH4NO3, зная, что Kа = 1,77 . 10-4, Kb = 1,77 . 10-5.
Ответ: 5,65 . 10-11, 3,20 . 10-6, 5,65 . 10-10.
30. Определите степень гидролиза и рН 0,005 N раствора KCN, если Ка = 4,9 . 10-10. Ответ: 0,063; 10,5.
Не нашли, что искали? Воспользуйтесь поиском: