
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задачи с решениями. 1. Вычислите константу диссоциации уксусной кислоты, если a для 0,1 М раствора её равна 1,35%. Дано: С(СН3СООН) = 0,1 M a = 1,35% = 0,0135 Ka = ?
1. Вычислите константу диссоциации уксусной кислоты, если a для 0,1 М раствора её равна 1,35%.
| Дано: С(СН3СООН) = 0,1 M a = 1,35% = 0,0135 Ka =? | Решение: CH3COOH «CH3COO- + H+ Ka = a2.С; Ka = (1,35.10-2)2.0,1 = 1,82.10-5 Ответ: Ka = 1,82.10-5. |
2. В 1 л 0,01 М раствора уксусной кислоты содержится 6,26 . 1021 её молекул и ионов. Определите изотонический коэффициент и степень диссоциации СН3СООН.
| Дано: V(p-pa) = 1 л C(CH3COOH) = 0,01 M N(всех частиц) = 6,26.1021 i =? a =? | Решение:
CH3COOH «CH3COO- + H+
1) n(CH3COOH) = C.V(р-ра) = 0,01 моль
2) N (молекул) = 6,02.1023.0,01 = 6,02.1021
3)  = 1,04 = 1,04
|
4)  = 0,04 или 4%.
= 0,04 или 4%.
Ответ: i = 1,04; a = 4%.
3. Вычислите ионную силу раствора, содержащего в 1 л воды 0,005 моль Cu(NO3)2 и 0,001 моль Al2(SO4)3 и активность ионов Cu2+ в растворе (r = 1 г/мл).
| Дано: n(Cu(NO3)2) = 0,005 моль n(Al2(SO4)3) = 0,001 моль V(H2O) = 1 л r = 1 г/мл I (p-pa) =? а (Cu2+) =? | Решение:
Cu(NO3)2 = Cu2+ + 2NO3- (1)
Al2(SO4)3 = 2 Al3+ + 3 SO42- (2)
I = 

|
1) По уравнению (1): n(Cu2+) = 0,005 моль, n(NO3-) = 2 . 0,005 = 0,01моль.
2) По уравнению (2): n(Al3+) = 2 . 0,001моль, n(SO42-) = 3 . 0,001= 0,003 моль.
3) I (p-pa) = 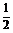 [0,005 . 22 + 0,001 (-1)2 + 0,002 . 32 + 0,003 . (-2)2] = 0,03 (моль/л).
[0,005 . 22 + 0,001 (-1)2 + 0,002 . 32 + 0,003 . (-2)2] = 0,03 (моль/л).
4) а (Cu2+) = f . C(Cu2+);  = 1,66; f = 0,46.
= 1,66; f = 0,46.
а (Cu2+) = 0,46 . 0,005 = 0,0023 (моль/л).
Ответ: I (p-pa) = 0,03 моль/л; а (Cu2+) = 0,0023 моль/л.
4. Определите концентрацию ионов ОН- и степень диссоциации ам-миака в 0,01 М растворе, зная что Kb = 1,77.10-5.
| Дано: C(NH3) = 0,01 моль/л Kb = 1,77.10-5 [OH-] =?, a =? | Решение:
NH3 + H2O «NH4+ + OH-
[OH-] = 
|
1) [OH-] =  = 4,2 . 10-4 (моль/л);
= 4,2 . 10-4 (моль/л);
2) a =  = 4,2 . 10-2 или a=
= 4,2 . 10-2 или a=  = 4,2 . 10-2.
= 4,2 . 10-2.
Ответ: [OH-] = 4,2 . 10-4 моль/л; a = 4,2 . 10-2.
Вопросы и задачи для самоподготовки.
1. Какие вещества называют электролитами? Чем отличаются водные растворы электролитов от растворов неэлектролитов?
2. Что понимают под электролитической диссоциацией (ионизацией)?
3. Какие величины являются количественными характеристиками процесса электролитической диссоциации (ионизации)?
4. На какие группы условно делят электролиты по степени их диссоциации? Приведите примеры.
5. Что называют активной концентрацией (активностью)? В каком соотношении она находится с аналитической концентрацией?
6. Что называют коэффициентом активности, и как изменяется его значение при разбавлении раствора?
7. Какими величинами определяется фактор активности для каждого иона и какой формулой выражается эта зависимость?
8. Что называют ионной силой раствора, и чем она определяется?
9. Запишите соотношения между ионной силой и молярной концентрацией разбавленных растворов для: а) бинарных электролитов с однозарядными и
двухзарядными ионами типа KCl и ZnSO4;
б) трех- и четырехионных электролитов типа Na2SO4 и FeCl3.
10. Как и почему влияет на степень диссоциации слабого электролита введение в его раствор одноименного иона и разбавление раствора?
11. Почему константа диссоциации (ионизации) является более удобной характеристикой электролита по сравнению со степенью диссоциации?
12. Какой формулой выражается закон разбавления Оствальда? Каковы границы применимости закона?
13. От каких факторов зависит константа диссоциации (ионизации)?
14. В каких случаях Кдисс. = C(электролита).a2. Ответ мотивируйте.
15. Почему в случае сильного электролита [Kt+] = C(KtAn), а в случае слабого электролита [Kt+] = C(KtAn).a?
16. Как найти концентрацию катиона слабого электролита KtAn, если известны: а) константа диссоциации и молярная концентрация электролита;
б) константа и степень диссоциации электролита?
17. Рассчитайте ионную силу раствора K2SO4, молярная концентрация которого равна 0,02 моль/л. Ответ: 0,06.
18. Определите ионную силу раствора, содержащего 1,62 г Са(НСО3)2 в 250 мл раствора. Ответ: 0,12.
19. Вычислите ионную силу раствора, содержащего 2,08 г BaCl2 и 5,85г NaCl в 500 мл раствора. Ответ: 0,26
20. Вычислите ионную силу и активность ионов в растворе, содержащем по 0,01 моль Ca(NO3)2 и CaCl2 в 1 л раствора.
Ответ: 0,06 моль/л; а (Ca2+) = 6,2.10-3, а (Cl-) = а (NO3-) = 1,5 . 10-2.
21. Степень диссоциации уксусной кислоты в 1N, 0,1N, 0,01N растворах соответственно равна 0,42%, 1,34% и 4,25%. Вычислите Ka для растворов указанных концентраций, докажите, что константа диссоциации не зависит от концентрации раствора.
22. Константа диссоциации HNO2 равна 5,1 . 10-4. Вычислите степень диссоциации в её 0,01 М растворе и концентрацию ионов Н+.
Ответ: 22,6%; 2,26 . 10-3моль/л.
23. Константа диссоциации Н3РО4 по первой ступени равна 7,11 . 10-3. Пренебрегая диссоциацией по другим ступеням, вычислите концентрацию ионов Н+ в 0,5 М растворе. Ответ: 5,96 . 10-2 моль/л.
24. Какова концентрация ионов Н+ в 1N растворе HCN, если её Ka = 4,9 . 10-10? Сколько (г) ионов содержится в 1,5 л раствора кислоты?
Ответ: 2,21 . 10-5моль/л; 5,97 . 10-4 г.
25. Определите степень диссоциации и концентрацию ионов ОН- в 0,1N растворе NH3, если Kb = 1,77 . 10-5. Ответ: 1,33%; 1,33 . 10-3 моль/л.
26. Во сколько раз концентрация ионов Н+ в 1 N растворе HNO3 (a = 0,82) больше, чем в 1 N растворе H2SO4 по первой ступени диссоциации (a = 0,51)? Ответ: в 1,6 раза.
27. Сколько воды необходимо добавить к 300 мл 0,2 М раствора СН3СООН, чтобы степень диссоциации кислоты удвоилась? Ответ: 900 мл.
28. В 1 мл 0,01 М раствора НСООН содержится 6,82 . 1018 её молекул и ионов. Определите степень диссоциации кислоты. Ответ: 13,3%.
Не нашли, что искали? Воспользуйтесь поиском: