
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Моляльная концентрация. 13. Рассчитайте моляльность 40%-ного раствора HNO3. Дано: w(HNO3) = 40% в(HNO3) = ? Решение: пусть m(p-p) = 100 г
13. Рассчитайте моляльность 40%-ного раствора HNO3.
| Дано: w(HNO3) = 40% в (HNO3) =? | Решение: пусть m(p-p) = 100 г, тогда: m(HNO3) = m(p-p). w(HNO3) = 100.0,4 = 40 г; |
m(H2О) = m(p-p) - m(HNO3) = 100 - 40 = 60 (г) = 0,06 (кг);
в (HNO3) =  = 10,6 (моль/кг).
= 10,6 (моль/кг).
Ответ: 10,6 моль/кг.
Вопросы и задачи для самоподготовки.
1. Каково содержание понятия «раствор»?
2. Какие существуют приближённые способы выражения концентрации растворов? Перечислите, дайте краткую характеристику каждому.
3. Какие способы выражения концентрации растворов относятся к точным? Перечислите.
4. Что понимают под массовой долей?
5. Чем отличается процентная концентрация от массовой доли?
6. Что понимают под молярной концентрацией?
7. Что такое эквивалент, фактор эквивалентности, молярная масса эквивалента? Приведите примеры определения.
8. Что понимают под молярной концентрацией эквивалента (нормальной концентрацией)?
9. Что такое титр раствора?
10. Как математически связаны между собой С(Х) и w(Х), С(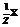 ) и С(Х), С(
) и С(Х), С(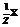 ) и w(Х)?
) и w(Х)?
11. Как математически связаны между собой С(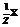 ) и t(Х)?
) и t(Х)?
12. Сколько (моль) FeSO4 . 7H2O надо прибавить к 100 мл воды, чтобы получить 10%-ный раствор FeSO4? Ответ: 0,18 моль.
13. К 250 г 10%-ного раствора кислоты добавили 500 г раствора той же кислоты с неизвестной массовой долей и получили 25%-ный раствор. Определите массовую долю кислоты в добавленном растворе. Ответ: 32,5%.
14. 125 л хлороводорода (н.у.) растворили в 500 мл воды. Определите массовую долю HCl в полученном растворе. Ответ: 29%.
15. В каком объёме 1 М раствора серной кислоты содержится 4,9 г H2SO4? Ответ: 50 мл.
16. Сколько (мл) 20%-ного раствора соляной кислоты с плотностью 1,098 г/мл потребуется для приготовления 1 л 2 М раствора?
Ответ: 332,4 мл.
17. Сколько (мл) 0,5 N раствора ВaСl2 можно приготовить из 24,4 г ВаСl2 . 2Н2О? Ответ: 400 мл.
18. Вычислите нормальную концентрацию и титр Н3РО4 в 13%-ном растворе, плотность которого 1,07 г/мл. Раствор предназначен для реакции, идущей до конца. Ответ: 4,26 N; 0,139174 г/мл.
19. В какой массе эфира надо растворить 3,04 г анилина C6H5NH2, чтобы получить раствор, моляльность которого равна 0,3 моль/кг? Ответ: 109 г.
20. Какой объём 3 N раствора должен быть прибавлен к 900 мл 0,5 N раствора этого же вещества, чтобы концентрация стала 1 N?
Ответ: 225 мл.
21. На реакцию с раствором, содержащим 0,498 г Na2B4O7 . 10H2O, израсходовано 25,2 мл раствора HCl. Вычислите молярную концентрацию эквивалента (нормальную концентрацию) раствора соляной кислоты. Ответ: 0,1032 N.
Не нашли, что искали? Воспользуйтесь поиском: