
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задачи с решениями. Массовая доля компонента.
Массовая доля компонента.
1. Глауберова соль Na2SO4 . 10H2O применяется при лечении желудочно-кишечных заболеваний как слабительное. Сколько (г) Na2SO4 . 10H2O нужно для приготовления 250 г раствора, с массовой долей Na2SO4, равной 5%.
| Дано: m(p-p) = 250 г. w(Na2SO4) = 5% = 0,05 m(Na2SO4.10H2O) =? M(Na2SO4) = 142 г/моль M(Na2SO4.10H2O)=322 г/моль | Решение:
1) m(Na2SO4 =  =
250.0,05 = 12,5 г;
2) по стехиометрической схеме:
Na2SO4 ® Na2SO4.10H2O
n(Na2SO4) = n(Na2SO4.10H2O) =
250.0,05 = 12,5 г;
2) по стехиометрической схеме:
Na2SO4 ® Na2SO4.10H2O
n(Na2SO4) = n(Na2SO4.10H2O)
 m(Na2SO4.10H2O) = 12,5.322/142 = 28,4 г.
Ответ: 28,4 г. m(Na2SO4.10H2O) = 12,5.322/142 = 28,4 г.
Ответ: 28,4 г.
|
2. Сульфат цинка ZnSO4 применяется в виде раствора с массовой долей, равной 0,25%, в качестве глазных капель. Сколько (г) воды нужно добавить к 25 г раствора с массовой долей ZnSO4, равной 2%, чтобы приготовить глазные капли?
      Дано:
m(p-p) = 25 г
w1(ZnSO4) = 2%
w2(ZnSO4) = 0,25%
m(H2O) =? Дано:
m(p-p) = 25 г
w1(ZnSO4) = 2%
w2(ZnSO4) = 0,25%
m(H2O) =?
| Решение:
В соответствии с «правилом креста» составим схему:
2% 0,25
0,25%
0% 1,75
 
 Ответ: 175 г. Ответ: 175 г.
|
3. Для компенсации недостатка соляной кислоты в желудочном соке применяют её растворы как лекарственные формы. Сколько (мл) 24%-ного раствора HCl с плотностью 1,12 г/мл необходимо для приготовления 500 г раствора с массовой долей 5%.
| Дано: r(p-p1) = 1,12 г/мл w1%(HCl) = 24% m(p-p 2) = 500 г w2%(HCl) = 5% V(p-p 1) =? | Решение:
m(HCl) =  = 500.0,05 = 25 г.
w1%(HCl) = = 500.0,05 = 25 г.
w1%(HCl) =   V(p-p 1) =
V(p-p 1) =  = 93 (мл).
Ответ: 93 мл. = 93 (мл).
Ответ: 93 мл.
|
4. Определите массовую долю (в %) HCl в растворе, полученном при смешивании 50 мл раствора с массовой долей 20% и 20 мл раствора, с массовой долей 10%.
| Дано: V(p-p1) = 50 мл r(p-p1)=1,1г/мл w1%(HCl)= 20% V(p-p 2) = 20 мл | Решение: 1) m1(HCl)=m(p-p1).w1(HCl)=V(p-p1).r(p-р1).w1(HCl) = 50.1,1.0,2 = 11 (г) 2) m2(HCl) = V(p-p 2).r(p-p2).w2(HCl) = 20.1,05.0,1= 2,1 (г) |
| r(p-p2)=1,05 г/мл w2%(HCl) = 10% w3%(HCl) =? | 3) w3%(HCl)=  = 17,2%.
Ответ: 17,2%.
= 17,2%.
Ответ: 17,2%.
|
Молярная концентрация
5. Для определения времени рекальцификации кровяной плазмы применяется раствор CaCl2 с молярной концентрацией 0,025 моль/л. Сколько (г) CaCl2 необходимо для приготовления 250 мл этого раствора?
| Дано: C(CaCl2) = 0,025 моль/л V(p-p) = 250 мл m(CaCl2) =? | Решение: V(p-p) = 250 мл = 0,25 л m(CaCl2) = C(CaCl2).М(CaCl2).V(p-p) = 0,025.111.0,25 = 0,6938 (г). Ответ: 0,6938 г. |
6. Сколько (мл) раствора H2SO4 с плотностью 1,26 г/мл (34,6%) нужно для приготовления 3 л 0,12 М раствора?
| Дано: r(p-p1) = 1,26 г/мл w1%(H2SO4) = 34,6% V(p-p 2) = 3 л C2(H2SO4)=0,12моль/л V(p-p 1) =? | Решение:
m1(H2SO4) = m2(H2SO4)
1) V(p-p1).r(p-p1).w1(H2SO4) = C2(H2SO4).M(H2SO4).V(p-p 2);
2) V(p-p 1).1,26.0,346 = 0,12.98.3  V(p-p1) =
V(p-p1) =  = 81 (мл)
Ответ: 81 мл. = 81 (мл)
Ответ: 81 мл.
|
7. Раствор NaCl с массовой долей 0,85% (r = 1,005 г/мл), называемый физиологическим раствором, применяется для внутривенных вливаний. Определите молярную концентрацию этого раствора.
| Дано: w1%(NaCl) = 0,85% r(p-p) = 1,005 г/мл C(NaCl) =? | Решение: I вариант:
Пусть V(p-p) = 1000 мл = 1 л; тогда:
m(р-р) = r(p-p).V(p-p) = 1,005.1000 = 1005 (г);
w1(NaCl) = 0,0085;
C(NaCl) =  = =
 = =  = 0,146 моль/л;
II вариант: В соответствии с формулой, приведённой в таблице 3 Приложения:
C(NaCl) = = 0,146 моль/л;
II вариант: В соответствии с формулой, приведённой в таблице 3 Приложения:
C(NaCl) =  = 0,146 (моль/л).
Ответ: 0,146 моль/л или 0,146 М. = 0,146 (моль/л).
Ответ: 0,146 моль/л или 0,146 М.
|
Молярная концентрация эквивалента (нормальная концентрация)
8. Сколько (г) Na2CO3 требуется для приготовления 1,5 л раствора с молярной концентрацией эквивалента 0,15 моль/л. Раствор предназначен для реакции, протекающей до конца.
Дано:
V(p-p) = 1,5 л
 =0,15 моль/л
m(Na2CO3) =? =0,15 моль/л
m(Na2CO3) =?
| Решение:
Пример реакции:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
f экв.(Na2CO3) = 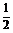 ; ;
 = = 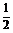 .106 = 53 г/моль;
m(Na2CO3)= .106 = 53 г/моль;
m(Na2CO3)=  .V(p-p). .V(p-p).  = 0,15.1,5.53 = 11,925 г.
Ответ: 11,925 г. = 0,15.1,5.53 = 11,925 г.
Ответ: 11,925 г.
|
9. Сколько (мл) раствора СаСl2 с массовой долей 10% (r = 1,04 г/мл) необходимо для приготовления 2 л раствора с молярной концентрацией эквивалента 0,05 моль/л? Раствор предназначен для реакции, идущей до конца.
Дано:
w1%(СaCl2) = 10%= 0,1
r(p-p1) = 1,04 г/мл
V(p-p 2) = 2 л
 =0,05моль/л
V(p-p 1) =? =0,05моль/л
V(p-p 1) =?
| Решение:
Пример реакции:
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
f экв.(CaCl2) = 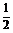 ; ;  = = 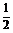 .111 = 55,5 (г/моль)
m(СaCl2) = V(p-p1). r(p-p1).w1(СaCl2) = .111 = 55,5 (г/моль)
m(СaCl2) = V(p-p1). r(p-p1).w1(СaCl2) =
|
 .
.  . V(p-p2)
. V(p-p2)  V(p-p1) =
V(p-p1) = 
=  = 53,35 (мл).
= 53,35 (мл).
Ответ: 53,35 мл.
10. Определите нормальную концентрацию (молярную концентрацию эквивалента) 50,1%-ного раствора H2SO4 с плотностью 1,4 г/мл. Раствор предназначен для реакции, идущей до конца.
Дано:
w1%(H2SO4)= 50,1%
r(p-p1) = 1,4 г/мл
 =? =?
| Решение: I вариант:
Пример реакции:
H2SO4 + 2 KOH = K2SO4 + H2O
f экв.(H2SO4) = 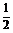 ; ;  = = 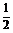 .98 = 49 г/моль
Пусть V(p-p) = 1000 мл = 1 л; тогда: .98 = 49 г/моль
Пусть V(p-p) = 1000 мл = 1 л; тогда:
|
m(р-р) = r(p-p) . V(p-p) = 1,4 . 1000 = 1400 (г);
 =
=  =
=
 = 14,2 моль/л (или 14,2н)
= 14,2 моль/л (или 14,2н)
II вариант: При решении задачи можно использовать формулу, приведённую в таблице 3 Приложения:
 =
=  = 14,2 (моль/л).
= 14,2 (моль/л).
Ответ: 14,2 моль/л.
11. Определите нормальную концентрацию 0,5М раствора Al2(SO4)3, предназначенного для реакции образования гидроксида алюминия.
Дано:
C(Al2(SO4)3) = 0,5M
 =? =?
| Решение:
Пример реакции:
Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4
f экв.(Al2(SO4)3) =  ; ;
 = 6. C(Al2(SO4)3) = 6.0,5 = 3 моль/л
Ответ: 3 моль/л (или 3 N). = 6. C(Al2(SO4)3) = 6.0,5 = 3 моль/л
Ответ: 3 моль/л (или 3 N).
|
12. Определите титр 0,15 N раствора Na2CO3, предназначенного для реакции полного ионного обмена (см. задачу 8).
Не нашли, что искали? Воспользуйтесь поиском: