
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задачи с решениями. 1. В 1 л воды растворяется 2,88.10-6 г AgI
1. В 1 л воды растворяется 2,88 . 10-6 г AgI. Вычислите ПР(AgI).
| Дано: V(H2O) = 1 л m(AgI) = 2,88.10-6г. ПР(AgI) =? | Решение:
AgI (тв) 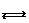 Ag+(р-р) + I-(р-р)
ПР(AgI) = [Ag+].[I-]
[Ag+] = [I-] = C(AgI) = Ag+(р-р) + I-(р-р)
ПР(AgI) = [Ag+].[I-]
[Ag+] = [I-] = C(AgI) = 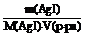
|
1) V(p-pa) = V(H2O) = 1 л, M(AgI) = 235 г/моль
2) C(AgI) = = 1,225 . 10-8 (моль/л)
3) ПР(AgI) = (1,225 . 10-8)2 = 1,5 . 10-16. Ответ: 1,5 . 10-16
2. Образуется ли осадок Fe(OH)3 в растворе, содержащем 1,5 . 10-3
моль/л FeCl3 и 5 . 10-5 моль/л NaOH? ПР(Fe(OH)3) = 3,8 . 10-38.
Дано:
C(FeCl3)= 1,5.10-3моль/л
C(NaOH) = 5.10-5 моль/л
ПP(Fe(OH)3) = 3,8.10 -38
ИП   ПР -? ПР -?
| Решение:
Fe(OH)3(тв) 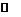 Fe3+(р-р) + 3 OH-(р-р)
ПP(Fe(OH)3) = [Fe3+].[OH-]3
1) [Fe3+] = C(FeCl3) = 1,5.10-3 моль/л
2) [OH-] = C(NaOH) = 5.10-5 моль/л
3) ИП(Fe(OH)3) = [Fe3+].[OH-]3 = 1,5.10-3.(5.10-5)3 = 1,9.10-6 Fe3+(р-р) + 3 OH-(р-р)
ПP(Fe(OH)3) = [Fe3+].[OH-]3
1) [Fe3+] = C(FeCl3) = 1,5.10-3 моль/л
2) [OH-] = C(NaOH) = 5.10-5 моль/л
3) ИП(Fe(OH)3) = [Fe3+].[OH-]3 = 1,5.10-3.(5.10-5)3 = 1,9.10-6
|
4) ИП >> ПР, следовательно, осадок образуется.
Ответ: осадок образуется.
3. При какой концентрации ионов Al3+ будет образовываться осадок
Al(OH)3 из раствора с рН = 6? ПР(Al(OH)3) = 5,1 . 10-33.
| Дано: pH = 6 ПР(Al(OH)3) = 5,1 . 10-33 [Al3+] =? | Решение:
Al(OH)3(тв) «Al3+(р-р) + 3 OH-(р-р)
[OH-] = 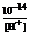 ; ; 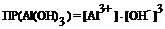
|
1) [H+] = 10-pH = 10-6 (моль/л);
2) [OH-] = 10-14/10-6 = 10-8 (моль/л);
3) [Al3+] = 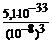 = 5,1 . 10-9 (моль/л). Ответ: 5,1 . 10-9 моль/л.
= 5,1 . 10-9 (моль/л). Ответ: 5,1 . 10-9 моль/л.
Вопросы и задачи для самоподготовки
1. Какое равновесие называют гетерогенным?
2. Выведите выражение произведения растворимости (ПР) малорастворимой соли на примере AgCl. При каких условиях осадки выпадают, растворяются
и находятся в равновесии с насыщенным раствором? Сравните ионное
произведение (ИП) с произведением растворимости (ПР).
3. Как влияет на растворимость вещества введение в его насыщенный раствор одноимённого иона? Ответ мотивируйте.
4. Выведите формулы для расчёта ПР по известной растворимости (s) для случаев: а) BaSO4; б) Mn(OH)2; в) Cr(OH)3; г) Mg3(PO4)2; д) KtnAnm.
5. Сколько (г) CaSO4 растворяется в 1 л воды, если ПР(CaSO4) = 6,1 . 10-5? Ответ: 1,062 г.
6. В 1 л воды растворяется 0,001215 г Са3(РО4)2. Вычислите ПР(Са3(РО4)2). Ответ: 1 . 10-25.
7. Какая из солей более растворима в воде и во сколько раз: хлорид или хромат серебра, если ПР(AgCl)= 1,1 . 10-10, ПР(Ag2CrO4) =1,6 . 10-12? V(p-pa) = V(H2O).
Ответ: хромат серебра, в 7,3 раза по молям, в 16 раз по массе.
8. Сколько (г) AgBr содержится в 10 л насыщенного раствора, если ПР(AgBr) = 4 . 10-13. Ответ: 1,19 . 10-3г.
9. Сколько (г) BaSO4 содержится в 100 л насыщенного раствора, если ПР(BaSO4) = 1 . 10-10. Ответ: 0,23 г.
10. Сколько (г) NaOH надо прибавить к 20 мл 5 . 10-5М раствора МgCl2, чтобы образовался осадок Mg(OH)2? ПР(Mg(OH)2) = 1,2 . 10-11. Изменением объема при добавлении щелочи и выпадении осадка пренебречь. Ответ: 3,9 . 10-4 г.
11. Сколько мл 2М раствора HCl необходимо прибавить к 20 мл 0,03М раствора Pb(NO3)2, чтобы образовался осадок PbCl2? ПР(PbCl2) = 2,4 . 10-4.
Ответ: 0,94 мл.
12. Образуется ли осадок CaSO4, если к 0,1М раствору CaCl2 добавить равный объём 0,1 М раствора H2SO4? ПР(CaSO4) = 6,1 . 10-5.
Ответ: ИП = 2,5 . 10-3; образуется.
13. При каком значении рН начнется образование осадка Mg(OH)2 из 2 . 10-2М раствора MgSO4? ПР(Mg(OH)2) = 1,2 . 10-11. Ответ: 9,38.
Не нашли, что искали? Воспользуйтесь поиском: