
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
С установлением закона постоянства состава в химию было введено понятие химического эквивалента или эквивалентного количества вещества элемента. В качестве исходных величин при определении химических эквивалентов приняты эквивалент водорода и эквивалент кислорода.
Химический эквивалент элемента – безразмерная (относительная) величина, равная отношению массы элемента к массе соединяющегося с ним водорода или к массе вещества, замещающего его в соединениях.
Количество вещества в граммах, численно равное его эквиваленту называется грамм – эквивалентом (широко применяемая и подлежащая изъятию единица массы химического элемента или соединения). Для перехода от массы, выраженной в грамм – эквиваленте, к количеству вещества, выраженному в молях, следует разделить числовое значение грамм – эквивалента: для химического элемента – на его валентность, для кислоты – на его основность (число ионов водорода), для основания – на его кислотность (число гидроксильных групп), для соли – на сумму зарядов образующих ее катионов или анионов, для окислителя (в реакциях окисления-восстановления) – на число электронов, полученных атомом (или атомами) восстановленного элемента.
Определение химических эквивалентов основывается на законе эквивалентов: все химические вещества взаимодействуют друг с другом в количестве, пропорциональном их эквивалентам.
Математически этот закон выражается зависимостью:
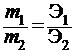 ,
,
где m 1 и m 2 − массы реагирующих веществ;
Э1 и Э2 – соответственно их эквиваленты.
Если одно из веществ находится в газообразном состоянии, то математически выражение закона принимает вид:
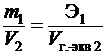 ,
,
где m и Э – массы реагирующих веществ;
V 2 – объем второго реагирующего вещества;
V г.-экв2 – объем, занимаемый одним грамм-эквивалентом этого вещества;
V 2 и V г.-экв2 должны быть измерены при одинаковых условиях (р и t).
При нормальных условиях V г.-экв2 водорода составляет 11200см3, V г.-экв2 кислорода – 5600 см3.
Химический эквивалент любого элемента устанавливают экспериментально химическим или электрохимическим путем. В основе химического определения лежит закон эквивалентов, а электрохимического определения – закон Фарадея. Среди различных методов определения эквивалентов наибольшее распространение получили:
Метод прямого определения. Эквивалент определяется из
данных прямого синтезаводородного или кислородного соединения данного элемента.
Пример. На окисление 0,253 г магния расходовалось 0,167 г кислорода. Чему равен эквивалент магния?
ЭМg =  .
.
Аналитический метод. Осуществляется точный анализ соединения данного элемента с любым другим, эквивалент которого известен, и по составу соединения вычисляется эквивалент.
Пример. Анализом хлористого серебра установлено, что оно содержит 75,26 % хлора. Определить эквивалент хлора, если известно, что эквивалент серебра равен 107,88:
ЭСl =  .
.
Метод вытеснения водорода используется для определения эквивалентов тех металлов, которые способны вытеснить водород из разбавленных кислот и щелочей. Эквивалент определяется из отношения массы данного элемента к массе или объему вытесненного водорода, соответственно и эквивалент V г.-экв2 водорода выражают в массовых или объемных единицах.
Пример. При взаимодействии 5,4 г металла с кислотой
выделилось 6720 см3 водорода, измеренного при нормальных условиях. Чему равен эквивалент металла?
ЭМе =  .
.
При вычислении объемов газа при нормальных условиях удобно пользоваться соотношением:
тонна-молекула занимает объем 22400 м3.
Электрохимический метод. Определяется массовое количество элемента, осаждающегося на электроде при электролизе соединения данного элемента. Эквивалент рассчитывают по закону Фарадея.
Пример. При пропускании тока силою 2 А в течение 2412 с через раствор азотнокислого серебра выделилось 0,539 г серебра. Чему равен эквивалент серебра?
ЭАg = 
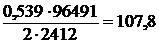
Химический эквивалент элемента Ээл можно вычислить, исходя из его атомной массы (А) и валентности (В):
Ээл = А / В.
Отсюда следует, что элемент, проявляющий в соединениях переменную валентность, будет иметь несколько значений эквивалентов.
Понятие «эквивалент» распространяется и на сложные соединения: оксиды, гидроксиды, кислоты, соли. Так как сложные соединения преимущественно вступают в реакции обмена, то по отношению к ним иногда применяют понятие «обменный эквивалент».
Эквивалент кислоты Эк − это такое ее количество, которое
содержит 1,008 частей водорода, способных к обмену. Его рассчитывают по формуле:
Эк = М к / n,
где М к = Эк − молекулярная масса кислоты;
Не нашли, что искали? Воспользуйтесь поиском: