
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электролитическая диссоциация. Вещества, диссоциирующие в воде или других полярных жидкостях и сплавах на ионы, называются электролитами
Вещества, диссоциирующие в воде или других полярных жидкостях и сплавах на ионы, называются электролитами, а явление распада на ионы − электролитической диссоциацией.
Ионы – это атомы или группа атомов, несущие положительный или отрицательный заряд.
Ионы подразделяются на простые: S2-, Cl−, Na+ и т. д.; сложные: ОН−, РО43−, NH4+ и т. д.; комплексные: Zn(OH)4]2−, α[Аg (NH3)2]+ и т. д.;
Электролиты – проводники второго рода.
Электропроводность электролитов обусловлена направленным движением ионов в электрическом поле.
Количественно способность вещества к диссоциации характеризует величина, называемая степенью диссоциации α − отношение числа ионизированных молекул к общему числу молекул растворенного вещества.
По степени диссоциации электролиты делятся на сильные (α > 0,3), средней силы (α = 0,3 + 0,10) и слабые (α < 0,10) электролиты.
К сильным электролитам принадлежат хорошо растворимые соли; большинство минеральных кислот, например H2SO4, HNO3, HI, HCl; основания щелочно-земельных металлов, например KOH, NaOH, Ca(OH)2.
К слабым электролитам относятся почти все органические кислоты, фенолы, амины; некоторые минеральные кислоты, например H2CO3, HCN, HNO2, HS; многие основания металлов и NH4ОН.
Сильные электролиты практически диссоциируют полностью. Закон действия масс для них неприменим:
 НСl H+ + Cl−.
НСl H+ + Cl−.
В растворах слабых электролитов имеются ионы и молекулы растворенного вещества. Следовательно, диссоциация слабых
электролитов представляет обратимый процесс, в результате которого устанавливается равновесие:
 HCNH+ + CN− NH4OH NH4+ + OH− .
HCNH+ + CN− NH4OH NH4+ + OH− .
Следует иметь в виду, что вследствие очень сильного поляризующего действия, ион Н+ в водном растворе существует не в свободном состоянии, а в виде соединения с молекулой воды Н3О+ (ион гидроксония).
Многоосновные кислоты и основания многозарядных катионов диссоциируют обратимо по ступеням:
Н 2СО3 H+ + Н СО3−; Сu(ОН)2 CuOH+ + OH−;
Н 2СО3 H+ + СО3−; Сu(ОН)2 Cu2+ + OH−.
К равновесию же, которое устанавливается в растворе слабого электролита, применим закон действующих масс.
Так, например, НNО2 ↔ H+ + NО2−; k =  = 4 ∙ 10−4.
= 4 ∙ 10−4.
Константа равновесия k, соответствующая диссоциации слабого электролита, называется константой диссоциации.
Чем больше способность электролита к диссоциации, тем больше значение константы. Константа диссоциации зависит от природы электролита и растворителя, от температуры и не зависит от концентрации. Поэтому она точнее, чем степень диссоциации.
В случае слабых многоосновных кислот или оснований многозарядных катионов, диссоциирующих ступенчато, каждая ступень диссоциации характеризуется своей константой.
Н3РО4 H+ + Н2 РО4− k =  = 7,51 ∙ 10 −3;
= 7,51 ∙ 10 −3;
Н2РО4− H+ + НРО42− k =  = 6,23 ∙ 10−8;
= 6,23 ∙ 10−8;
НРО4− H+ + Н РО43− k = 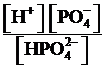 = 2,2 ∙ 10−13.
= 2,2 ∙ 10−13.
Определив опытным путем степень диссоциации, вычисляют
значение константы на основании закона разбавления Освальда:
k = a2 С,
где С – молярная концентрация электролита.
Для труднорастворимых электролитов также применим закон действующих масс, так как между осадком и его ионами в растворе устанавливается равновесие:
AgCl − в осадке; Ag+ + Cl−− в растворе.
В момент наступления равновесия раствор становится насыщенным.
Количественно это равновесие можно характеризовать константой равновесия:
k =  .
.
Так как концентрация твердой соли есть величина постоянная, то можно записать [Ag+] · [Cl −] = [AgCl] = 1,7 · 10 −10. Произведение [Ag+] · [Cl−] = 1,7 · 10−10 называется произведение растворимости (ПР), т. е. произведением концентрации ионов в насыщенном растворе труднорастворимого электролита.
Как только произведение концентрации находящихся в растворе ионов станет больше ПР, электролит выпадает в осадок. Добавление к труднорастворимому электролиту сильного электролита с одноименными ионами смещает равновесие в сторону образования осадка:
AgCl Ag+ + Cl−, AgNО3 Ag+ + NО3− .
Увеличение в данной равновесной системе концентрации ионов снижает растворимость данного электролита.
Добавление же к труднорастворимому электролиту сильного электролита, ионы которого связывают ионы данного электролита в молекулы, повышает его растворимость:
 Zn(OH)2 2H+ + ZnO22−;
Zn(OH)2 2H+ + ZnO22−;
 2NaOH 2Na+ + 2OH−;
2NaOH 2Na+ + 2OH−;
 Zn(OH)2 + 2OH− ZnO22− + 2H2O.
Zn(OH)2 + 2OH− ZnO22− + 2H2O.
Равновесие в системе будет смещаться вправо, т. е. растворимость Zn(OH)2 возрастает.
Взаимодействие сильных электролитов с образованием осадка:
 Ba2+ + SO42− = BaSO4;
Ba2+ + SO42− = BaSO4;
 Ca2+ +SO42− = Ca SO4 .
Ca2+ +SO42− = Ca SO4 .
Взаимодействие двух сильных электролитов с образованием слабого:
KCN + HCl = KCl + HCN.
Взаимодействие осадка с кислотой:
 |
CaCO3 + 2H+ = Ca2+ + H2O + CO2 ;
 CO32− +2H+ = CO2 + H2O.
CO32− +2H+ = CO2 + H2O.
Ионные реакции с образованием слабого электролита:
 |
NH+ + OH− = NH3 + H2O.
Амфотерные электролиты.
Не нашли, что искали? Воспользуйтесь поиском: