
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Общие методические указания. Домашняя подготовка. При изучении необходимо знать:
Домашняя подготовка. При изучении необходимо знать:
1) законы квантово-волновой механики;
2) принципы формирования электронной оболочки многоэлектронных атомов;
3) типы химической связи (ковалентная полярная и неполярная, ионная);
4) основные положения метода валентных связей (МВС);
5) свойства ковалентной связи;
6) что является основным условием образования гибридных структур?
7) типы гибридизации, формы молекул и углы связи;
8) особенность построения геометрической формы молекул с кратными связями.
Таблица 1
| Номер варианта | Приведите характе-ристику элемента на основании его поло-жения в периоди-ческой системе Д. И. Менделеева | Укажите тип связи в данных молекулах | По методу валентных связей постройте графи-ческие формулы молекул |
| Sb, Mn S, Co P, Ca Hg, Se Cl, Fe Br, Ca Cd, As Cr, S Cu, P Fe, CI Br, Nа Ni, Sn Si, P Zn, As Co, Br Ba, Se As, Se Zn, N P, Pb I, Ni | H2Se, MgO H2O, SnCl2 AsH3, CaO CO2, CaCl2 H2S, Al2O3, CaCl2, ZnO Al2O3, PbI2 CaI2, SO2 SiF4, CoS Fe2O3, RbCl Fr2O, NiCl2 SiF4, FeCl3 F2, PH3 KCl, SiH4 BCl3, H2O2 H2Se, K2O I2, SiF4 MgI2, H2Te K2O, NaBr [NH4]+, AsH3, | C H3 CОН, SbCl 3 CO2, N2 SiF4, C H3 CООН CОCl2, CH3OH CSCl2, N2, SiH4, CO2 С2H2. AsH3 BF3, COS SbH3, HCN, C 6H6, H2S H3BO3, N2, SiF4, CS2 AsH3, HCN C2N2, PH3 C2H2, H3BO3 Zn Cl2, C2H4 C 3H 6, F2, Al(OH)3, CS2 HCN, BeCl2 SbH3, C 3H 4 |
Вопрос 1. Приведите характеристику элемента на основании его положения в Периодической системе.
S – находится в IV периоде VI группы главной подгруппы, следовательно она относится к р-семейству.
S 1s22s22p63s23p4


 +16S…3s23p4 3p ↓↑ ↑ ↑
+16S…3s23p4 3p ↓↑ ↑ ↑
 3s ↓↑ K=II
3s ↓↑ K=II
 +16S*…3s23p33d1 3d ↑ — — — — 3d
+16S*…3s23p33d1 3d ↑ — — — — 3d


 3p ↑ ↑ ↑ K=IV
3p ↑ ↑ ↑ K=IV
 3s ↓↑
3s ↓↑

 +16S*…3s13p33d2 3d ↑ ↑ — — —
+16S*…3s13p33d2 3d ↑ ↑ — — —


 3p ↑ ↑ ↑
3p ↑ ↑ ↑
 3s ↓↑ K=VI
3s ↓↑ K=VI
С. О. – 2, 0, +2, +4, +6
С. О. + 2 для серы малохарактерна
С. О. – 2 0 +4 +6
H2S S8 SO2 SO3
H2SO3 H2SO4
Na2SO3 Na2SO4
NaHSO3 NaHSO4
Вопрос 2. Укажите тип связи в данных молекулах:
Na2O, CI2, CCI4
Na2O ∆X=3,5 – 0,93= 2,57, т.к. ∆X › 2, то связь ионная
CI2 ∆X=0 – следовательно связь ковалентная неполярная
CCI4 ∆X=2,83 – 2,5=0,33, т.к. ∆X ‹ 2, то связь ковалентная полярная
Вопрос 3. По МВС постройте молекулы AsН3S, ВеCl2
AsН3
Н

3) Н — As —Н,

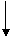



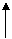 33As …4s24p3 4p К=3
33As …4s24p3 4p К=3
4s
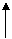
 1H 1S1 1S K=1
1H 1S1 1S K=1
Угол связи равен 90°, молекула имеет
форму пирамиды.
1) ВеС12 Сl ¾ Ве ¾ Сl
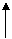
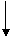 4Ве...2s2 __ __ __
4Ве...2s2 __ __ __
 2s К=0
2s К=0

 4Ве*...2s12р1 2р ¾ ¾ К=2
4Ве*...2s12р1 2р ¾ ¾ К=2
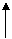 2s ___
2s ___
 sр-гибридизация
sр-гибридизация
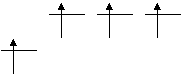
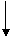
17Cl…3s23p5 3p
 |
3s
К=1
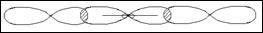 Молекула имеет линейную форму,
Молекула имеет линейную форму,
угол связи равен 180
Задание 2
Не нашли, что искали? Воспользуйтесь поиском: