
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретические пояснения. Кинетика – наука о скорости химических реакций
Кинетика – наука о скорости химических реакций. Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции зависит от ряда факторов: природы реагирующих веществ, концентрации реагирующих веществ, температуры, наличия катализатора.
1) Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
Н2(г) + I2 (г) → 2HI(г)
закон действующих масс может быть записан  (5.1) где
(5.1) где  — скорость химической реакции;
— скорость химической реакции;  — константа скорости;
— константа скорости;  и
и  концентрации реагирующих веществ.
концентрации реагирующих веществ.
Реакции в гетерогенной системе осуществляются на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции:
С(к) + О2(г) → СО2(г)
закон действующих масс имеет вид  (5.2) где
(5.2) где  - константа скорости;
- константа скорости;  - концентрация кислорода; S - площадь поверхности раздела между фазами.
- концентрация кислорода; S - площадь поверхности раздела между фазами.
2) Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
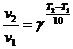 (5.3)
(5.3)
где v1 и v2 скорости реакции при Т2 и Т1,  - температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 оС.
- температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 оС.
Более точно влияние температуры на скорость химической реакции можно определить с помощью уравнения Аррениуса:
υ ~ k = A·e-Ea/R·T, (5.4)
где υ – скорость химической реакции; k – константа скорости (скорость при концентрациях реагентов, равных 1); A – предэкспоненциальный множитель; e – экспонента; R – газовая постоянная (8,31 Дж/моль·К); T – температура, К; Eа – энергия активации, кДж/моль.
Значение предэкспоненциального множителя (A) определяется природой реагентов, вступающих в реакцию.
A = z·P, (5.5)
где z – коэффициент, равный числу соударений молекул в одну секунду в данной реакции; P- стерический фактор, определяющий вероятность взаимодействия данных молекул.
Величина энергии активации (Eа) в уравнении Аррениуса имеет точное значение для каждой химической реакции и определяется природой реагирующих веществ. Энергия активации – избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества. Молекулы, обладающие такой энергией, называются активными молекулами.
Для того, чтобы произошла реакция, необходимо сначала преодолеть отталкивание электронных оболочек молекул, разорвать или ослабить связи между атомами исходных веществ. На это надо затратить определенную энергию. Если энергия сталкивающихся молекул достаточна, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества. При разрыве или ослаблении связей между атомами в молекулах исходные вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования и необходима энергия активации (Eа). Неустойчивый активированный комплекс существует короткое время. Он распадается с образованием продуктов реакции или исходных веществ, при этом энергия выделяется. Переходное состояние возникает в ходе как прямой, так и обратной реакции. Энергетически оно отличается от исходных веществ на величину энергии активации прямой реакции, а от конечных – на энергию активации обратной реакции.
С ростом температуры наблюдается увеличение энергии системы, и соответственно увеличивается доля молекул, энергия которых равна или превышает энергию активации данной химической реакции, что приводит к росту её скорости.
3) Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
Не нашли, что искали? Воспользуйтесь поиском: