
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Методика проведения опытов. 5.2.1 Опыт 1 Зависимость скорости реакции от концентрации реагирующих веществ.
5.2.1 Опыт 1 Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере взаимодействия тиосульфата натрия с серной кислотой:
Nа2S2О3 + Н2S04 = S02 + Nа2S04 + H2O + S
Признаком реакции является помутнение раствора вследствие выделения серы.
Заполните три бюретки: первую – 1н раствором Н2S04, вторую – 0,05 н раствором Nа2S2О3, третью — водой. Приведите бюретки в рабочее положение.
Налейте в три пробирки из бюретки по 1 мл Н2S04. В другие три пробирки из бюреток налейте: в первую — 1 мл раствора Nа2S2О3 и 2 мл воды; во вторую – 2 мл раствора Nа2S2О3 и 1 мл воды; в третью – 3 мл раствора Nа2S2О3 и 0 мл воды.
Заметив время, в первую пробирку прилейте из пробирки 1 мл отмеренного раствора серной кислоты и быстро перемешайте полученную смесь. Отметьте время начала помутнения раствора. Проделайте то же самое с двумя оставшимися пробирками.
Рассчитайте uпракт для второго и третьего случаев, учитывая, что скорость реакции и время протекания реакции до начала помутнения раствора обратно пропорциональны. Следовательно:
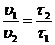
где u1 – скорость реакции в первом случае (v1 = 1); u2 – скорость реакции во втором (третьем) случае; τ1 – время протекания реакции до начала помутнения раствора в первом случае, с; τ2 – время протекания реакции до начала помутнения раствора во втором случае, с.
Результаты опыта внесите в табл.5.1
Таблица 5.1 – Результаты опыта №1
| № п/п | Объем, мл | Относительная концентрация | Температура опыта, °С | Время начала помутнения, с | Относительная скорость реакции | ||||
| H2S04 | Н2О | Na2S2O3 | uтеор | 1/τ | uпракт | ||||
| комнатная | |||||||||
| комнатная | |||||||||
| комнатная |
5.2.2 Опыт 2 Зависимость скорости реакции от температуры.
Зависимость скорости реакции от температуры изучают на примере реакции
Nа2S2О3 + Н2S04 = Nа2SО4 + S02 + H2O + S
По правилу Вант - Гоффа (при γ = 1,8) получаем, что при повышении температуры на 10° скорость реакции увеличится в 1,8 раза, на 20° - в 3,24 раза, на 30° - в 5,832 раза и т.д.
Приведите бюретки с растворами Nа2S2О3, Н2S04 и водой в рабочее положение.
В две пробирки из бюретки прилейте по 1 мл Н2S04. В две другие пробирки из бюреток прилейте по 1 мл раствора Nа2S2О3 и по 2 мл воды.
Одну пару пробирок (одна пробирка с Н2S04, другая с 1 мл Nа2S2О3 и 2 мл воды) поместите в стакан с горячей водой с температурой на 10° выше комнатной. Через 5-7 мин, когда растворы нагреются до нужной температуры, смешайте их и определите время помутнения раствора, как в опыте 1.
Другую пару пробирок поместите в термостат с температурой на 20о выше комнатной. Через 5-7 мин смешайте растворы и определите время начала помутнения.
Рассчитайте uпракт для второго и третьего случаев (методика расчета дана выше). На миллиметровой бумаге постройте кривую зависимости uтеор от температуры. На этом же графике отметьте значения uпракт.
Рассчитайте значение температурного коэффициента γпракт исходя из опытных данных.
Результаты опыта запишите в табл. 5.2 (экспериментальные данные для комнатной температуры возьмите из опыта 1, № п/п 1).
Таблица 5.2 – Результаты опыта №2
| № п/п | Объем, мл | Общий объем, мл | Температура опыта, 0С | Время начала помутнения, с | Относительная скорость реакции | ||||
| H2S04 | Н2О | Na2S2O3 | uтеор | 1/τ | uпракт | ||||
| комнатная | |||||||||
| комнатная +10 | 1,8 | ||||||||
| комнатная + 20 | 3,24 |
5.2.3 Опыт 3 Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе (полумикрометод)
Взаимодействие карбоната кальция с соляной кислотой. Приготовьте два небольших приблизительно одинаковых кусочка мела. Один из них разотрите пестиком на листе бумаги и пересыпьте в коническую пробирку, второй поместите в другую пробирку. В обе пробирки одновременно добавьте по 15-20 капель концентрированной соляной кислоты. Напишите уравнение реакции. Отметьте наблюдаемые явления и объясните их.
5.2.4 Опыт 4 Зависимость скорости реакции от природы реагирующих веществ.
В две пробирки поместите примерно одинаковые промытые водой кусочки цинка. В первую пробирку прилейте 0,1 М раствора HCI, в другую 0,1 М раствора уксусной кислоты. Отметьте, в какой из пробирок газ выделяется более интенсивно. Чем объяснить различную скорость выделения водорода в первом и во втором случаях? Напишите уравнения реакций взаимодействия цинка с уксусной и соляной кислотами.
Не нашли, что искали? Воспользуйтесь поиском: