
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Внешними факторами миграции являются температурный режим, давление, кислотно-основные и окислительно-восстановительные условия среды.
Температурный режим. С повышением температуры увеличивается миграционная способность элементов, находящихся в растворах и расплавах, повышается скорость химических реакций (принцип Ле-Шателье).
Давление. При изучении гидротермальных, магматических и метаморфических процессов обязательно учитывают такой внешний фактор, как давление. В пределах же биосферы и почв давление существенного влияния не оказывает, т.к. значительного изменения его не наблюдается.
Кислотно-основные условия среды. Концентрация ионов Н+ также оказывает значительное влияние на водную миграцию элементов в зоне гипергенеза. Этот фактор контролирует осаждение из растворов многих соединений, коагуляцию коллоидов, влияет на поступление элементов в растения, на подвижность многих металлов (табл. 5).
Таблица 5
Значения рН начала осаждения гидрооксидов некоторых элементов из разбавленных растворов
| Элемент | рН | Элемент | рН | Элемент | рН | Элемент | рН |
| Zr4+ Sn2+ Ce4+ Fe3+ Hg+ In3+ Th4+ | 2,0 3,0 2,7 2,48 3,0 3,4 3,5 | Al3+ U6+ Cr3+ Cu2+ Fe2+ Be2+ Pb3+ | 4,1 4,2 5,3 5,3 5,5 5,7 6,0 | Сd2+ Ni2+ Co2+ Y3+ Sm3+ Zn2+ Nd3+ | 6,7 6,7 6,8 6,8 6,8 7,0 7,0 | Hg2+ Ce3+ La3+ Ag+ Mn2+ Mg2+ | 7,3 7,4 8,4 9,0 9,0 10,5 |
Образование комплексных анионов сильно осложняет эту картину. Например, рН осаждения UO2(ОН)2 3,80–6,00 (в зависимости от концентрации урана в растворе). Т.е. при значениях рН выше 6,00 миграция UO22+ не должна происходить. Но известно, что уран в таких водах мигрирует. Это связано с образованием растворимых карбонатных комплексов. Для большинства металлов образование комплексных ионов повышает рН осаждения гидрооксидов и повышает растворимость вообще.
Nа, Са, К, Rb, Сs в земной коре не образуют гидроксидов и для их осаждения рН вод имеет лишь косвенное значение, как фактор, влияющий на сорбцию, растворимость солей и т.д.
Необходимо иметь в виду, что повышение температуры изменяет ионное произведение воды [H+] · [ОН–] и при t =100°С в нейтральной среде рН =6,12, а при t =400 °С – 5,50, а, следовательно, изменяются в термальных водах и растворимости гидроксидов металлов.
4. Окислительно-восстановительные условия. Эти условия очень сильно влияют на миграцию элементов. Важнейшие окислители – О2, Fе3+, Мn4+, восстановители – S2+, Fе2+, Н2.
В бескислородной обстановке (для почв – глеевая среда) увеличивается миграционная способность катионогенных элементов и уменьшается – анионогенных, ускоряется разложение алюмосиликатов.
В восстановительной сероводородной среде Н2S вступает в реакции со многими металлами, вызывая их осаждение из раствора. Восстановительная обстановка даже периодического характера в теплое время года сопровождается интенсивной миграцией соединений Fе, Мn, Со, Ni, Сu. При усилении анаэробной обстановки железо присутствует в болотных водах в виде Fе2+. Чем меньше доступ кислорода и ниже значения рН, тем выше подвижность соединений железа. В периоды аэрации начинается переход Fе2+ в Fе3+ и интенсивное выпадение в осадок, накопление его соединений.
Особую роль в водной миграции играют коллоиды. Миграция в коллоидной форме характерна для гумуса, соединений Si, А1, Fе, Мn, Zг, Sn, Тi, V, Сr, Ni и многих других элементов. Одна из особенностей процесса сорбции на коллоидах – селективность. Состав сорбируемых веществ во многом определяется зарядом сорбента. Преимущественно сорбируются ионы, имеющие общую атомную группировку. Лучше сорбируются поливалентные, чем моновалентные ионы, а среди моновалентных – те, чей радиус больше.
Таким образом, физико-химическая миграция подчиняется законам физики и химии и обусловливается такими процессами, как диффузия, растворение, осаждение, сорбция, десорбция и т.д. При этом она может протекать в ионной или коллоидной форме.
Интенсивность миграции выражается скоростью перехода в подвижное состояние одного грамма вещества данного элемента:
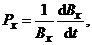 (4)
(4)
где Px – интенсивность миграции; Вх – число атомов элемента, перешедших в подвижное состояние; d Вх /d t – число атомов элемента x, перешедших в подвижное состояние за время d t.
Чем больше величина Вx, тем меньше интенсивность миграции. Величина Вх зависит от кларка концентрации (К k) элемента. При сходных химических свойствах элемент с меньшим К k мигрирует интенсивнее.
Миграционная способность химических элементов различается очень значительно, но все же удается сгруппировать элементы по их подвижности. По этой классификации все элементы разделены на следующие 4 группы.
1. Литофильные – отличаются сродством к кислороду и в условиях биосферы образуют минералы, представленные оксидами, гидрооксидами, солями кислородных кислот. К их числу относятся 54 элемента и в первую очередь, это Si, Ti, S, Р, F, С1, А1, Nа, К, Са, Mg.
2. Халькофильные элементы – склонные давать соединения с серой. Это – Сu, Рb, Zn, Сd, Аg, Мn, Fе и др.
3. Сидерофильные – растворяются в железных расплавах и дают соединения и сплавы с железом. Это – Fе, Ni, Со, Р, С, Pt, Мо, Аu, Sn.
4. Атмофилы – элементы, входящие в земную атмосферу: Н, N, С, О, Не, Аr, Сl и др.
Также выделяют особую группу элементов – биофилов: С, Н, О, Р, N, S, С1, I; и в меньшей мере – В, Са, Мg, К, Na, Мn, V, Fе, Сu.
Конечно, в данной классификации есть много условного, наблюдаются взаимопроникновения (повторы), она характеризует поведение элементов преимущественно в жидких фазах (растворах), а также распределение элементов между твердыми и жидкими фазами.
Б.Б. Полынов (1933) вычислил условные единицы миграции элементов путем деления содержания компонента в горной породе на его количество в омывающих породы водах (табл. 6).
Таблица 6
Миграционная способность элементов
| Компоненты | Средний химический состав кристаллических горных пород, % | Средний химический состав растворенных веществ в водах, омывающих горные породы, % | Миграционная способность (условные единицы) |
| SiO2 | 59,09 | 12,80 | 0,20 |
| Al2O3 | 15,35 | 0,90 | 0,02 |
| Fe2O3 | 7,29 | 0,40 | 0,04 |
| Са2+ | 3,60 | 14,70 | 3,0 |
| Мg2+ | 2,11 | 4,90 | 1,3 |
| Nа+ | 2,97 | 9,50 | 2,4 |
| К+ | 2,57 | 4,40 | 1,25 |
| Cl– | 0,05 | 6,75 | |
| SО42– | 0,15 | 11,60 | |
| CO32– | – | 36,50 | ∞ |
Это позволило ему объединить химические элементы по геохимической подвижности в группы, названные им рядами миграции (табл. 7).
Таблица 7
Миграционные ряды элементов в коре
| Ряд элементов | Состав ряда | Показатель порядка величины миграции |
| Энергично выносимые | Cl, Br, I, S | 2n · 10 |
| Легко выносимые | Са, Na, K, Мg | n |
| Подвижные | Si(силикатов), P, Mn | 2n · 10–1 |
| Инертные | F, Al, Ti | 2n · 10–2 |
| Практически неподвижные | Si(кварца) | 2n · 10–3 |
Более подробная геохимическая классификации элементов по особенностям их миграции в ландшафтах была дана А.И. Перельманом (табл. 8). В основе этой классификации лежит деление на воздушные и водные мигранты. Первые мигрируют как в газообразном состоянии, так и с водным раствором. Вторые в газообразном состоянии не мигрируют или мигрируют слабо. В классификации учтена зависимость миграционной способности химических элементов в разных окислительно-восстановительных средах.
Таблица 8
Геохимическая классификация элементов по особенностям их миграции
| ВОЗДУШНЫЕ МИГРАНТЫ | |
| Активные (образуют химические соединения) | Пассивные (не образуют химические соединения) |
| О, Н, С, N, I | Аr, Не, Nе, Кr, Хе, Rn |
| ВОДНЫЕ МИГРАНТЫ | |
| Катионогенные | Анионогенные |
| Очень подвижные | |
| Са, Nа, Мg, Sr, Rа | Cl, Вr, S, F, В |
| Слабо подвижные | |
| К, Ва, Рb, Li, Ве, Cs, T | Si, Р, Gе, Sn, Sb, Аs |
| Подвижные и слабо подвижные в окислительной обстановке и инертные в сероводородной среде, осаждаются на щелочных барьерах, мигрируют в окислительной обстановке | |
| Zn, Сu, Ni, Сd | Hg, Ag, Bi |
| Подвижные и слабо подвижные в окислительной обстановке, инертные в восстановительной среде, осаждаются на сероводородных и глеевых барьерах | |
| V, Мо, Sе, U, Rе | |
| Подвижные и слабо подвижные в восстановительной глеевой среде, инертные в окислительной и восстановительной сероводородной средах | |
| Fe, Мn, Со | |
| Мало подвижные в большинстве обстановок | |
| Слабая миграция с органическими комплексами. Частично мигрируют в сильно кислой среде: | Частично мигрируют в щелочной среде: |
| Ti, Сr, Се, Nb, Y, La, Ga, Th, Sc, Sm, Gd | Zr, Nb, Та, W, Hf, Те, Тb, Но, Еu, Yb, In, Lu |
| Не образуют химических соединений (самородковое состояние) | |
| Os, Pd, Ru, Pt, Au, Rh, Zr |
Конечно, все эти классификации довольно условны и их следует воспринимать примерно так же, как и распределение элементов по различным средам. Там выявляется общий тип распределения элементов по различным оболочкам, но в конкретных средах могут сложиться совсем иные соотношения, не отвечающие среднему содержанию. Точно так же и оценка подвижности элементов дана в целом для биосферы как некая общая характеристика, тогда как в реальной природной обстановке могут складываться условия, резко изменяющие подвижность химических элементов. Именно потому, что в классификации А.И. Перельмана по возможности учтен этот фактор, она представляется более удачной для целей почвоведения и более полезной для биогеохимии.
В почвенной среде главные факторы среды, влияющие на растворимость и подвижность элементов, следующие: рН среды, окислительно-восстановительный потенциал, наличие и свойства органического вещества, присутствие сопутствующих катионов и анионов, емкость поглощения, минералогический состав.
Известны и почвы с рН до 10,00–11,00. Таковы содово-засоленные почвы, глубокие горизонты орошаемых почв. Таким образом, интервал рН достигает 8,00–11,00 единиц, в то же время для гидрооксидов трехвалентных металлов изменение рН на единицу вызывает изменение растворимости по катионам на 3 порядка. Для двухвалентных – на 2 порядка, а для одновалентных катионов – на порядок. Необходимо учитывать также, что в почвах низкие значения рН, как правило, соответствуют промывному режиму, и вполне реальным представляются в таких условиях вынос практически любых катионов, разрушение карбонатов и алюмосиликатов.
Не нашли, что искали? Воспользуйтесь поиском: