
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Три 6 ‑ гекса 9 ‑ нона 12 ‑ додека
Числительные более 12 указываются арабскими цифрами через дефис и читаются как количественные числительные. Неопределенное число атомов обозначается приставкой «поли». Для твердых полиморфных модификаций допускается их обозначение греческими буквами: α, b, g, d и т.д., начиная с низкотемпературной модификации (табл. 1).
Таблица 1 - Названия простых веществ
| Символ | ИЮПАК | Тривиальное (традиционное) название |
| Н | моноводород | атомарный водород |
| Н2 | диводород | молекулярный водород |
| О3 | трикислород | озон |
| Р4 | тетрафосфор | белый фосфор |
| Рn | полифосфор | черный фосфор |
| S8 | цикло-октасера | кристаллическая сера, построенная из циклических молекул S8 (λ-сера) |
| α-S | α-cера | сера ромбическая |
| β-S | β-сера | сера моноклинная |
| Sn | катена-полисера | μ-сера пластическая, построенная из полимерных цепных молекул |
Название простых ионов. Название простых катионов строится из слова “катион” в именительном падеже и русского названия элемента в родительном падеже, если катион одноатомный. В случае необходимости римской цифрой в скобках указывают степень окисления элемента (табл. 2).
Если катион многоатомный, то стехиометрические отношения можно выражать с помощью системы Штока или системы Эванса-Бассета (табл. 3).
Названия анионов строятся из корня латинского названия элемента, суффикса «ид» и слова «ион». Например, Н- ‑ гидрид-ион, N3- ‑ нитрид-ион. S22- ‑ дисульфид (2-)-ион, J3- ‑ трииодид (1-)-ион.
Таблица 2 ‑ Названия одноатомных катионов
| Катион | Международная номенклатура ИЮПАК | Русский вариант ИЮПАК |
| Н+ | водород катион | катион водород |
| Fe2+ Fe3+ | железо (II) катион железо (III) катион | катион (ион) железо (II), (читается ион железо два) катион (ион) железо (III) |
Таблица 3 ‑ Названия многоатомных катионов
| Катион | Русский вариант ИЮПАК | |
| система Штока | система Эванса-Бассета | |
| Н2 + | катион диводорода (I) | ион диводорода (1+) (читается: ион диводорода один плюс) |
| Hg2 2+ | катион диртути (II) | ион диртути (2+) |
| О2 + | катион дикислорода (I) | ион дикислорода (1+) (катион диоксигенила) |
Названия сложных катионов и анионов. Названия сложных ионов строятся по принципам номенклатуры комплексных соединений (например, NH 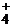 ), в которых различают центральный атом (N) и атомы или молекулы, или ионы, связанные с ним, т.е. лиганды (от лат. liqare ‑ связывать, соединять) (Н).
), в которых различают центральный атом (N) и атомы или молекулы, или ионы, связанные с ним, т.е. лиганды (от лат. liqare ‑ связывать, соединять) (Н).
Некоторым катионам и анионам вместо систематических названий даны специальные:
N2H5+ ‑ катион гидразиния (1+), VO2+ ‑ катион ванадил,
NO2 + ‑ катион нитрил, ОН- ‑ гидроксид-ион,
CN- ‑ цианид-ион, CN  ‑ цианамид-ион,
‑ цианамид-ион,
NCS- ‑ тиоцианат-ион, O  ‑ озонид-ион,
‑ озонид-ион,
О  ‑ пероксид-ион, О
‑ пероксид-ион, О  ‑ надпероксид-ион или гипероксид-ион,
‑ надпероксид-ион или гипероксид-ион,
Катионы, образованные некоторыми элементами с водородом и включающие большее число атомов водорода, чем требуется по правилу нейтральности, носят групповое название ‑ ониевые катионы. Их специальные названия:
H2F+ ‑ катион фторония, H3O+ ‑ катион оксония,
H3S+ ‑ катион сульфония, NH 4+ ‑ катион аммония,
PH4+ ‑ катион фосфония, AsH4+ ‑ катион арсония,
Названия сложных веществ. Химическая формула сложного вещества включает в себя условно электроположительную составляющую, или реальный катион, и условно электроотрицательную составляющую, или реальный анион, причем катион в формуле ставится на первое место, анион ‑ на второе. Исключение: NH2OH, NH3 и N2H4. Если катионов или анионов несколько, то первым пишется ион менее электроотрицательного элемента, например: KNaCl2, NaNH4Cl2, BiClO, Ba2(SeO4)(SO4).
Названия электроотрицательных и электроположительных составляющих в сложных веществах строятся так же, как названия свободных анионов и катионов, лишь слова “ион” и “катион” опускаются.
Составлять систематическое название сложного вещества, например Mn2O7, можно двумя способами: 1) используя числовые приставки: гептаоксид димарганца; 2) указывая степень окисления менее электроотрицательного элемента: оксид марганца (VII) ‑ способ Штока. Названия, построенные по второму способу, менее громоздки, но первый способ более универсален и точен. Например, нельзя назвать по методу Штока соединение Fe3C. Или другой пример ‑ бромид ртути (I) отвечает формуле HgBr, а не истинной молекулярной формуле вещества Hg2Br2. Используя первый способ построения названия, эти соединения определяют, соответственно, как карбид трижелеза и дибромид диртути, т.е. однозначно. Оба способа построения названия используют в зависимости от целесообразности: PtCl ‑ монохлорид платины, (NO)NO2 ‑ диоксонитрат (III) нитрозила, H2S2O2 ‑ диоксодисульфат диводорода, Cr23C6 ‑ гексакарбид 23-хрома.
При наличии нескольких электроотрицательных или электрополо-жительных составляющих их названия перечисляют в алфавитном порядке, что не всегда соответствует формуле, и пишут через дефис: FeCuS2 ‑ дисульфид железа-меди, AsOF3 – оксид-трифторид мышьяка, Sr(HS)Cl – гидросульфид-хлорид стронция, V3O5(OH)4 ‑ тетрагидроксид-пентаоксид триванадия. Для интерметаллических соединений названия состоят из одного слова: AuCu3 ‑ золототримедь.
Для однозначного обозначения веществ одинакового состава, но с разным расположением атомов в названиях указывают химическим символом (через дефис) тот элемент, который присоединен к другой составляющей, например, НОСN ‑ цианат-О водорода, HNCO ‑ цианат-N водорода, HCNO ‑ цанат-С водорода.
Название гидратов. Название гидратов начинается со слова “гидрат” с указанием, если нужно, числа молекул воды греческим числительным:
NH3.H2O ‑ гидрат аммиака, FeSO4.7H2O ‑ гептагидрат сульфата железа (II), Fe2O3.nH2O ‑ полигидрат оксида железа (III).
Если состав гидратов более сложный, то название начинают со слова “гидрат” без числовых приставок, а в конце указывают в круглых скобках арабскими цифрами в виде дроби стехиометрическое соотношение составных частей, причем первая цифра отвечает содержанию воды, например: 2NH3.H2O ‑ гидрат аммиака (1/2), 3CdSO4.8H2O ‑ гидрат сульфата кадмия (8/3). В случае клатратов, наоборот, вторая цифра отвечает содержанию воды, например, 6Br2.46H2O ‑ дибром-вода (6/46).
Название гидридов. Большинство гидридов называют, добавляя к корню латинского названия суффикс -ан; если число неводородных атомов превышает единицу, то его указывают числовой приставкой, например: H2S ‑- сульфан, ВН3 ‑ боран, H2S2 ‑ дисульфан, В2Н6 ‑ диборан. Исключение составляют вода, галогеноводороды, аммиак и остальные гидриды элементов УА группы (при образовании названия последних используется суффикс -ин, например: PH3 – фосфин).
Название бескислородных кислот. Водные растворы бинарных соединений водорода с галогенами и халькогенами являются кислотами. Их название строится из названия элемента, окончания “о” и слов “водородная кислота”: НСl(aq) ‑ хлороводородная кислота (aq ‑ aqua ‑ вода в качестве растворителя), H2Te2(aq) ‑ теллуроводородная кислота.
Аналогично строятся названия водных растворов псевдогалогенидов водорода, например: HCN(aq) ‑ циановодородная кислота, HN3(aq) ‑ азидоводородная кислота, HNCS(aq) ‑ тиоциановодородная кислота.
Название оксокислоти их солей. Систематическое название строится из слов «водород» или «кислота» и названия кислотного остатка по принципу названий комплексных соединений. Например: H2SO4 ‑ тетраоксосульфат (VI) водорода, или тетраоксосерная (VI) кислота; H2MnO4 ‑ тетраоксомарганцовая (VI) кислота, или тетраоксомарганганат (VI) водорода; H3MnO4 ‑ тетраоксомарганцовая (V) кислота, или тетраоксомарганат (V) водорода.
Названия наиболее распространенных кислот остаются традиционными. Если элемент образует оксокислоту в высшей или единственной степени окисления, то ее название состоит из корня русского названия элемента (или группы элементов) и суффикса ‑ ная, овая, евая. Hазвания кислот, которые элемент образует не в высшей степени окисления, строятся аналогично, но используются суффиксы ‑ ов, ист, новат, или новатист, в зависимости от возможной степени окисления элемента.
Если элемент в одной и той же степени окисления образует кислоты, различающиеся по “содержанию воды”, то названия кислот (а также их солей) начинаются с префиксом орто-, мезо- или мета-, смысл которых ясен из примеров: H5JO6 ‑ ортойодная кислота, H3JO5 ‑ мезойодная кислота, HJO4 ‑ метайодная кислота, H3PO4 ‑ ортофосфорная кислота, HPO3 ‑ метафосфорная кислота (табл. 5).
Таблица 5- Традиционные названия кислот и кислотных остатков
| Формула кислоты | Традиционное название кислоты | Название кислотного остатка | Графическая формула кислоты |
| H3AsO4 | ортомышьяковая | ортоарсенат | 
|
| H3AsO3 | ортомышьяковистая | ортоарсенит | 
|
| H2CO3 | угольная | карбонат | 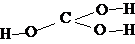
|
| H2CrO4 | хромовая | хромат | 
|
| H2Cr2O7 | дихромовая | дихромат | 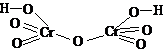
|
| HClO | хлорноватистая | гипохлорит | H-O-Cl |
| HClO2 | хлористая | хлорит | H-O-Cl=O |
| HClO3 | хлорноватая | хлорат | 
|
| HClO4 | хлорная (перхлорная) | перхлорат | 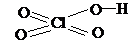
|
 HMnO4 HMnO4
| марганцовая | перманганат | 
|
| Продолжение таблицы 5 | |||
| H2MnO4 | марганцеватая | манганат | 
|
| H2MnO3 | марганцовистая | манганит | 
|
| HNO3 | азотная | нитрат | 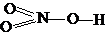
|
| HNO2 | азотистая | нитрит | O=N-O-H |
| HOCN | циановая | цианат | H-O-C≡N |
| HNCO | изоциановая | изоцианат | H-N=C=O |
| H3РO4 | ортофосфорная | ортофосфат | 
|
| H4P2O7 | дифосфорная | дифосфат | 
|
| H2SO4 | серная | сульфат | 
|
| H2SO3 | сернистая | сульфит | 
|
| H2SO5 | пероксомоносерная | пероксосульфат | 
|
| H2S2O8 | пероксодисерная | пероксодисульфат | 
|
| H2S2O3 | тиосерная | тиосульфат | 
|
Оксокислоты, содержащие два или более центральных атома, носят групповое название поликислот и в их конкретное название вводят соответствующую числительную приставку. Например: H2S2O7 ‑ дисерная кислота.
Традиционные названия средних солей образуют из названия кислотного остатка и катиона: FeSO3 – сульфит железа (III).
Традиционные названия основных солей (гидроксосолей) образуют, добавляя к наименованию аниона соответствующей средней соли приставку гидроксо-: Cu2(OH)2CO3 ‑ гидроксокарбонат меди (II).
Традиционные названия кислых солей образуют, добавляя к наименованию аниона соответствующей соли приставку гидро-: KHSO3 ‑ гидросульфит калия или сульфид калия-водорода, Na2H2P2O7 ‑ дигидродифосфат натрия или дифосфат (V) динатрия-диводорода.
Не нашли, что искали? Воспользуйтесь поиском: