
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Обезвреживание аммиака в организме
Реакции дезаминирования аминокислот и азотистых оснований, окисление биогенных аминов приводят к образованию в тканях токсичного для организма аммиака. Аммиак токсичен и его содержание в крови должно быть предельно мало, иначе возможно нарушение функции мозга и развитие комы. В растениях аммиак содержится также в незначительных количествах. В живых организмах существуют механизмы обезвреживания аммиака.
Одним из путей связывания и обезвреживания аммиака является биосинтез глутамина (возможно аспарагина).
Основной механизм обезвреживания аммиака – биосинтез мочевины. Мочевина выводится с мочой; у растений может накапливаться в заметных количествах, особенно в растениях, имеющих на корнях микоризу.
Основным местом синтеза мочевины является печень. Образование мочевины происходит в результате нескольких ферментативных реакций, которые составляют орнитиновый цикл. Г.Кребс и К.Гензеляйт впервые в 1932 г. вывели уравнения реакций синтеза мочевины (рис.21).
Образование мочевины протекает в несколько этапов. На первом этапе синтезируется макроэргическое соединение карбомоилфосфат – метаболитически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов и аргинина. В настоящее время открыты три разных пути синтеза карбомоилфосфата.
Первая реакция (необратимая) идет при участии фермента –аммиакзависимой карбомоилфосфатсинтетазы:

Реакция требует затраты двух молекул АТФ, открыта в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины.
Вторую, также необратимую, реакцию катализирует глутаминзависимая карбомоилфосфатсинтетаза:

Реакция открыта в цитозоле клеток животных и требует наличия ионов Mg2+.
Третью обратимую реакцию катализирует карбаматкиназа (реакция открыта у микроорганизмов).

На втором этапе цикла мочевинообразования происходит конденсация кабомолфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карбомоилтрансфераза. На следующей стадии цитруллин превращается в аргинин в результате двух последующих реакций. Первая из них – конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (реакцию катализирует аргининосукцинатлиаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
На синтез одной молекулы мочевины требуется затрата четырех высокоэнергетических фосфатных групп: две молекулы АТФ расходуются на синтез карбомоилфосфата и одна - на образование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и РРi, который при гидролизе также образует две молекулы Рi.

Рис. 21. Орнитиновый цикл синтеза мочевины в печени
В процессе эволюции живые организмы выработали различные типы азотистого обмена. Это аммониотелический тип, при котором главным конечным продуктом азотистого обмена является аммиак; он свойствен преимущественно рыбам. При уреотелическом типе обмена основным конечным продуктом обмена является мочевина; такой тип характерен для человека и животных. Урикотелический тип характерен для птиц и рептилий; главным конечным продуктом данного типа обмена является мочевая кислота.
Биосинтез белка
Фенотипические признаки любого организма проявляются в разнообразии и количестве белков, кодируемых ДНК. Передача наследственной информации (экспрессия генов) может быть выражена схемой: ДНК ® РНК ® Белок.
На первой стадии реализации генетической информации, называемой т ранскрипцией, происходит «переписывание» нуклеотидной последовательности ДНК в одноцепочечные молекулы РНК. В результате транскрипции образуются мРНК, кодирующие аминокислотные последовательности белков, а также тРНК, рРНК и другие виды РНК, выполняющие структурные, регуляторные и каталитические функции.
В основе транскрипции лежит принцип комплементарности. Транскрипция схожа с репликацией, но отличается рядом особенностей: не требует синтеза праймера, использует не всю молекулу ДНК, а только ее отдельные короткие сегменты (отдельные гены или группы генов), требует наличия только одной из цепей ДНК в качестве матрицы.
Процесс образования молекулы мРНК на матрице ДНК в прокариотических клетках представляется относительно простым. Во многих случаях первичным продуктом экспрессии гена является молекула мРНК, уже способная к функционированию. У эукариот, в связи с наличием экзонно-интронного строения генов, мРНК проходит стадию созревания – процессинга. Процессинг иРНК включает три основных процесса: 1) кэпирования – химическая модификация 5/-концевой последовательности мРНК; 2) сплайсинга – удаление некодирующих интронных последовательностей из мРНК и сшивание образующихся экзонов; 3) полиаденилирования – химическая модификация 3/-последовательности мРНК.
Химический смысл кэпирования сводится к присоединению остатка 7/-метилгуанозина посредством трифосфатной группы к 5/-концу молекулы транскрипта, метилированию 2/-ОН-группы первого и второго нуклеотидов на 5/-конце мРНК. Полиаденилирование 3/-конца первичного транскрипта включает ряд стадий и участие эндонуклеазы и полиаденилатполимеразы. Эндонуклеаза расщепляет мРНК вблизи специфической сигнальной последовательности (5/) ААУААА (3/), отличающейся высокой консервативностью. Полиаденилатполимераза синтезирует поли-А конец (от 20 до 250 нуклеотидов) начиная с точки распада. Считается, что основное назначение 5/-кэп и поли-А – это защита мРНК от энзиматического распада.
Второй этап реализации генетической программы – трансляция, при котором информация, закодированная в первичной структуре нуклеиновых кислот, переводится в аминокислотную последовательность синтезируемых белков. Перевод осуществляется с правилами генетического кода. Полная расшифровка генетического кода была закончена в 1966 г. М. Ниренбергом, С. Очао, Н.Г. Кораном.
Генетический код устанавливает соответствие между нуклеотидной последовательностью данной мРНК и аминокислотной последовательностью данной синтезируемой на ней полипептидной цепи. Генетический код характеризуется следующими свойствами: триплетностью, специфичностью, непрерывностью, вырожденностью, универсальностью.
Генетический код триплетен, три нуклеотидных остатка (триплет) кодируют одну аминокислоту.
Специфичность генетического кода заключается в том, что один триплет кодирует только одну аминокислоту (каждую аминокислоту кодируют только определенные кодоны).
Генетический код непрерывен, не содержит «запятых», «знаков препинания», т.е. сигналов, указывающих на конец одного кодона и начало другого. Код линейный, однонаправленный и непрерывающийся, в процессе синтеза белка последовательность мРНК считывается группами по три нуклеотида. Это свойство обеспечивает синтез точной последовательности аминокислотных остатков в молекуле белка.
Генетический код вырожден. Число кодирующих триплетов в три раза больше числа аминокислотных остатков, многие аминокислоты кодируются двумя и более кодонами. Вырожденность генетического кода проявляется в том, что для каждой аминокислоты существует более одной тРНК, и одна тРНК может взаимодействовать более чем с одним кодоном мРНК. В трехбуквенном генетическом коде наиболее важны первые буквы, тогда как третья буква часто бывает разной. В связи с преобладающей ролью первых двух букв кодонов генетический код иногда называют квазидуплетным (псевдодуплетным). Эта особенность кода позволяет использовать меньшее число тРНК: для взаимодействия с 61 кодоном достаточно 31 тРНК в цитоплазме и всего 22 тРНК в белоксинтезирующей системе митохондрий животных.
Генетический код универсален, т. е. един для всех живущих на Земле организмов – от бактерий до человека. Небольшие отличия имеются, однако, в генетическом коде митохондрий и хлоропластов.
В таблице 12 представлены последовательности триплетов всех кодонов, ответственных за включение каждой из 20 аминокислот в белковую молекулу.
Таблица 12
Генетический кодовый «словарь»
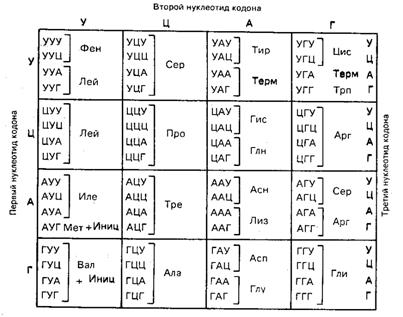
Среди 64 кодонов 61 кодируют определенную аминокислоту, а три (АУГ, УАА, УГА) являются нонсен-кодонами («бессмысленные», так как не кодируют ни одной из 20 аминокислот). Однако эти кодоны не лишены смысла, они выполняют важную функцию сигналов терминации (окончания) в синтезе полипептида в рибосомах. Первым (основным) стоп-кодоном является УАА, а на небольшом расстоянии следом за ним располагается один из других терминирующих триплетов (УГА, УАГ).
Не нашли, что искали? Воспользуйтесь поиском: