
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Синтез и распад гликогена
Синтез гликогена (гликогенез) происходит путем увеличения существующей затравки молекулы гликогена за счет последовательного присоединения отдельных молекул глюкозы.
Синтез гликогена – процесс энергозависимый. Когда глюкоза входит в клетку, она подвергается фосфорилированию посредством АТФ. Эту реакцию в мозге и мышцах катализирует гексокиназа, в печени другой фермент – глюкокиназа. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фосфат:
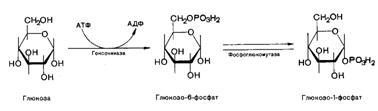
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена.
На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с уридинтрифосфатом (УТФ), образуя уридинфосфатглюкозу (УФГ-глюкоза) и пирофосфат. Реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ- пирофосфорилаза):
Глюкозо-1-фосфат + УТФ 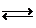 УДФ – глюкоза + Пирофосфат.
УДФ – глюкоза + Пирофосфат.
На второй стадии происходит перенос гликозидного остатка, входящего в состав УДФ- люкозы, на гликозидную цепь гликогена (затравку). При этом образуется a(1® 4)-связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется гликогенсинтетазой:

Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ и, таким образом, весь цикл превращений глюкозо-1-фосфата начинается сначала.

Печень запасает глюкозу в виде гликогена не столько для своих собственных нужд, сколько для обеспечения поступления глюкозы к другим тканям, особенно к мозгу и эритроцитам. В перерывах между приемами пищи печень расщепляет накопленный в ней гликоген с такой скоростью, чтобы по возможности удерживать на постоянном уровне концентрацию глюкозы в крови.
Ключевую роль в распаде гликогена играет фосфоролитический распад. Под действием гликогенфосфорилазы гликоген распадается с образованием фосфорного эфира глюкозы (глюкозо-1-фосфата):
(С6 Н10 О5)n + Н3 РО4 ® (С6 Н10 О5)n -1 + Глюкозо-1-фосфат,
где (С6 Н10 О5)n означает полисахаридную цепь гликогена, а (С6 Н10 О5)n -1 - ту же цепь, но укороченную на один глюкозный остаток.
Образовавшийся глюкозо-1-фосфат далее изомеризуется фосфоглюкомутазой в глюкозо-6-фосфат, который гидролизуется до глюкозы, и последняя выделяется в кровь (рис. 25).
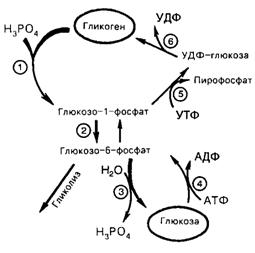 Рис. 25. Распад и синтез гликогена
Рис. 25. Распад и синтез гликогена
Окисление глюкозы
Важнейшими источниками энергии для обеспечения физиологических процессов организма является гликоген и глюкоза. За счет распада гликогена (гликогенолиз) обеспечиваются энергией печень и мышцы, тогда как другие органы, в первую очередь мозг, для этой цели используют распад глюкозы.
Окисление глюкозы до СО2 и НО2 можно разделить на три этапа.
1. Гликолиз – процесс расщепления глюкозы на два трехуглеродных фрагмента (молекулы пировиноградной кислоты), сопряженный с восстановлением переносчика электронов; протекает в цитоплазме клетки.
2. Цикл Кребса (синонимы: цикл лимонной кислоты, цикл трикарбоновых кис-
лот) – совокупность реакций, в результате которых второй и третий атомы углерода пировиноградной кислоты превращаются в СО2, с восстановлением переносчиков электронов. В этом процессе кислород не участвует.
3. Электронтранспортная цепь – это цепь переноса электронов на О2, после чего он, забирая из окружающей среды водород в виде протонов, превращается в НО2. У эукариот эта стадия происходит во внутренней мембране митохондрий. Стадия сопровождается образованием наибольшего количества АТФ.
Гликолиз
Гликолиз – (от. греч. glycys - сладкий и lysis - растворение, распад) – бескислородный распад, в ходе которого синтезируются две молекулы АТФ на молекулу глюкозы. Конечными продуктами гликолиза являются пируват и NADH. Процесс гликолиза катализируется одиннадцатью ферментами.
Первой реакцией является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой и считается практически необратимой:

Второй реакций гликолиза является превращение глюкозо-6-фосфата под действием фермента глюкозо-6-фосфата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат. Реакция легко протекает в обоих направлениях, и для нее не требуется каких-либо кофакторов:

Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:

Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бифосфат расщепляется на две фосфотриозы. Реакция обратима.
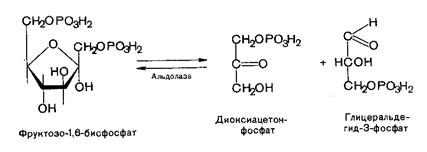
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:
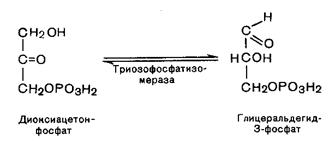
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бифосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Реакция протекает в несколько этапов:

Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты (3-фосфоглицерат):
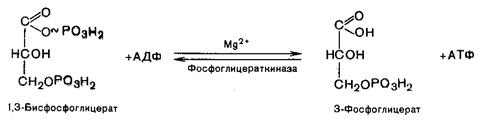
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат). Реакция легко обратима, протекает в присутствии ионов Mg2+.
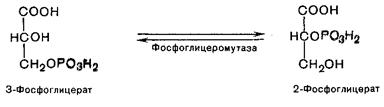
Девятая реакция катализируется ферментом енолазой, при этом фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:
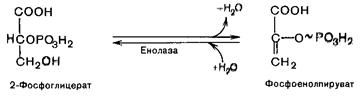
Енолаза активируется двухвалентными катионами Mg2+ или Mn2+ и ингибируется фторидом.
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:
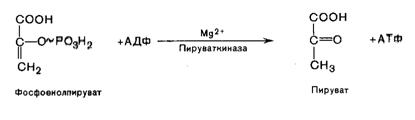
Для действия пируватканизы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.) Внутри клетки реакция является практически необратимой.
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

Последовательность реакций, протекающих при гликолизе, показана на рис. 26.
|
|
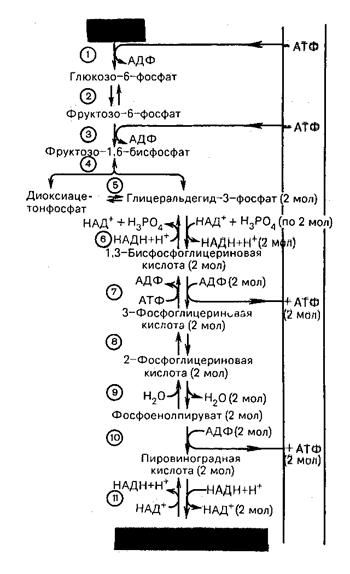
Рис. 26. Последовательность реакций гликолиза
1 - гексокиназа, 2 - фосфоглюкоизомераза, 3 - фосфофруктокиназа, 4 - альдолаза,
5 - триозофосфоизомераза, 6 - глицеральдегидфосфатдегидрогеназа,
7 - фосфоглицераткиназа, 8 - фосфоглицератмутаза, 9 - енолаза, 10 - пируваткиназа,
11 - лактатдегидрогеназа
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфатных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофруктокиназная реакции). На последующих образуется 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза составляет 2 молекулы АТФ на одну молекулу глюкозы.
Если гликолиз протекает в аэробных условиях, пируват и НАДН поступают в митохондрии, где пируват окисляется до СО2 и НО2, а НАДН в НАД.
При анаэробном гликолизе происходит образование молочной кислоты из пирувата. Анаэробный гликолиз происходит в мышцах в первые минуты мышечной работы, в эритроцитах, в которых нет митохондрий, а также в различных органах и тканях при недостаточном снабжении их кислородом.
У многих микроорганизмов, растущих в анаэробных условиях, гликолиз является основным катаболитическим путем, предназначенным для извлечения пирувата из углеводных субстратов; дальнейшее превращение пирувата приводит к образованию определенных конечных продуктов метаболизма – продуктов брожения. Химическая природа этих продуктов зависит от вида микроорганизма и условий протекания процесса, в которых один и тот же микроорганизм осуществляет брожение.
Основными типами брожений являются спиртовое, молочнокислое, маслянокислое и др.
Цикл Кребса
Цикл лимонной кислоты (цикл Кребса, цикл лимонной кислоты) представляет серию реакций, протекающих в митохондрий.
Пируват, образовавшийся при гликолизе, попадает внутрь митохондрий, благодаря транспортной системы, обеспечивающей его антипорт с ионами ОН-.
Ацетильные углеродные атомы с ацетил-КоА, которые ранее принадлежали пирувату, превращаются в СО2, и параллельно с этим 3 молекулы НАД+ восстанавливаются в НАНД, а 1 молекула ФАД – в ФАДH2. Кроме того, следствием всех этих превращений является синтез ГТФ.
В матриксе митохондрий пируват превращается в ацетил-КоА, после чего ацильная группа пирувата вступает в цикл лимонной кислоты.
Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс» (рис.27).
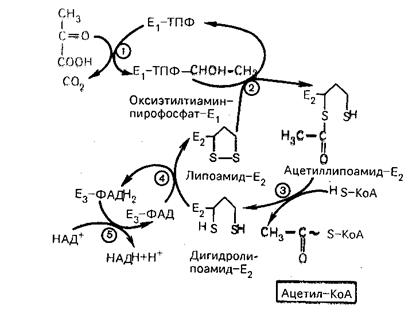
Рис 27. Механизм действия пируватдегидрогеназного комплекса
Е1 - пируватдегидрогеназа, Е2 - дигидролипоилацетилтрансфераза,
Е3 - дигидролипоилдегидрогеназа
На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (Е1). На II второй стадии оксиэтильная группа комплекса Е1- ТПФ- СНОН- СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидролипоилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-КоА) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид-Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный в ФАДH2 дигидролипоилдегидрогенеазы передает водород на кофермент НАД+ с образованием НАДН + Н+.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях, ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис 28).

Рис. 28. Цикл Кребса (цикл лимонной кислоты)
Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятия водорода) и двух декрбоксилирований (отщепления СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и НО2, а молекула оксалоацетата регенерируется.
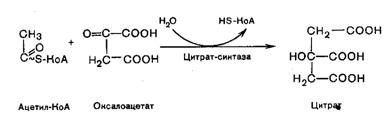
Первая реакция катализируется ферментом цитратсинтетазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате образуется лимонная кислота:

В результате второй реакции образовавшаяся лимонная кислота подвергается дегидрированию с образованием цис -аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимопревращение Н и ОН в молекуле цитрата:
В третьей реакции изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы:
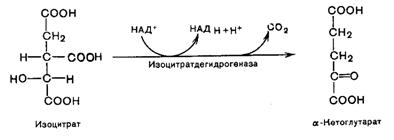
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ и для проявления своей активности фермент нуждается в Mg2+ и Mn2+.
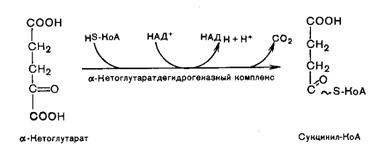
Во время четвертой реакции происходит окислительное декарбоксилирование a-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. В реакции участвуют 5 коферментов: ТПФ, амид липоевой кислоты, HS-КоА, ФАД и НАД+:
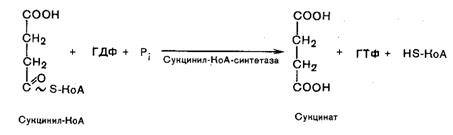
Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
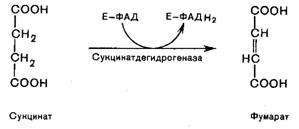
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь, сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной:
Седьмая реакция осуществляется под влиянием фермента фумаратдегидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является L-яблочная кислота (малат):

В восьмой реакции цикла под влиянием митохондрильной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:

За один оборот цикла происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны окисляться в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованных во внутренней мембране митохондрий.
При окислении глюкозы в результате гликолиза и цикла Кребса образуется: 2 молекулы АТФ на 1 молекулу глюкозы в процессе гликолиза и столько же в цикле лимонной кислоты (с учетом энергетической эквивалентности ГТФ и АТФ); еще одна молекула АТФ образуется, если источником глюкозы служит гликоген. Большая часть энергии запасается в виде 10 молекул НАДН (две из гликолиза, две из пируватдегидрогеназной реакции и шесть из цикла лимонной кислоты) и 2 молекулы ФАДН2 (из цикла лимонной кислоты). Следует помнить, что из глюкозы образуется 2 молекулы пирувата, которые обеспечивают 2 оборота цикла.
Основное количество АТФ, синтезируемого из АДФ и Р в ходе окисления глюкозы, образуется при окислении ФАД и НАД+.
Не нашли, что искали? Воспользуйтесь поиском: