
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Карбонаты (гидрокарбонаты)
A. К 0,2 г карбоната (гидрокарбоната) или к 2 мл раствора карбоната (гидрокарбоната) (1:10) прибавляют 0,5 мл разведенной кислоты; выделяется диоксид углерода, который образует белый осадок при пропускании через известковую воду.
NaHCO3 + НС1 - NaCl + CO2↑ + Н2О
СО2 + Са(ОН)2 - СаСО3 ↓ + Н2О
Б. К 2 мл раствора карбоната (1:10) прибавляют 5 капель насыщенного раствора магния сульфата; образуется белый осадок (гидрокарбонат образует осадок только при кипячении смеси).
4Na2CO3 + 4MgSO4 + 4Н2О → 3MgCO3 • Mg(OH)2 • 3H2O↓ + CO2↑ + 4Na2SO4
B. Раствор карбоната (1:10) при прибавлении 1 капли раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбонатов - реакция среды более щелочная).
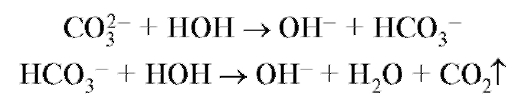
Магний
К 1 мл раствора соли магния (0,002-0,005 г иона магния) прибавляют 1 мл раствора аммония хлорида, 1 мл раствора аммиака и 0,5 мл раствора фосфата натрия; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте.

Натрий
А. 1 мл раствора соли натрия (0,01-0,03 г иона натрия) подкисляют разведенной уксусной кислотой, если необходимо, фильтруют, затем прибавляют 0,5 мл раствора цинк-уранилацетата; образуется желтый кристаллический осадок.
NaCl + Zn(UO2)3(CH3COO)8 + CH3COOH +6H2O →
→ NaZn(UO2)3(CH3COO)9 • 6H2O↓ + HCl Б. Соль натрия, смоченная хлороводородной кислотой и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Нитраты
А. К препарату (около 0,001 г иона нитрата) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.

Б. К препарату (0,002-0,005 г иона нитрата) прибавляют по 2-3 капли воды и концентрированной серной кислоты, кусочек металлической меди и нагревают; выделяются бурые пары диоксида азота.
2NaNO3 + H2SO4 → Na2SO4 + 2HNO3
Cu + HNO3 → Cu(NO3)2 + NO2↑ + H2O В. Нитраты (около 0,002 г иона нитрата) не обесцвечивают раствор калия перманганата, подкисленный разведенной серной кислотой (отличие от нитритов).
Нитриты
А. К препарату (около 0,001 г иона нитрита) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.
Б. К препарату (около 0,03 г иона нитрита) прибавляют 1 мл разведенной серной кислоты; выделяются желто-бурые пары (отличие от нитратов).
NaNO2 + H2SO4 → NaHSO4 + HNO2 2HNO2 → NO↑ + NO2↑ + H2O
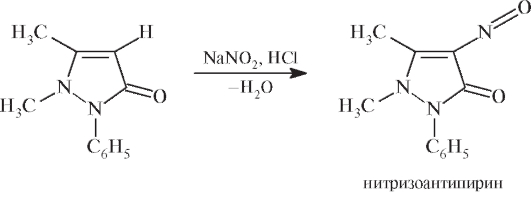
В. Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 каплях разведенной хлороводородной кислоты, прибавляют 2 капли раствора нитрита (около 0,001 г иона нитрита); появляется зеленое окрашивание (отличие от нитратов).
Сульфаты
К 2 мл раствора сульфата (0,005-0,05 г иона сульфата) прибавляют 0,5 мл раствора бария хлорида; образуется белый осадок, нерастворимый в разведенных минеральных кислотах.

Сульфиты
А. К 2 мл раствора сульфита (0,01-0,03 г иона сульфита) прибавляют 2 мл разведенной хлороводородной кислоты и встряхивают; постепенно выделяется сернистый газ, обнаруживаемый по характерному резкому запаху.
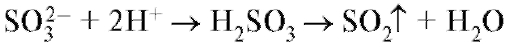
Б. К 2 мл раствора сульфита (0,002-0,02 г иона сульфита) прибавляют 0,5 мл раствора хлорида бария; образуется белый осадок, растворимый в разведенной хлороводородной кислоте (отличие от сульфатов).

В. При добавлении к раствору сульфита нескольких капель раствора йода (0,1 моль/л) реактив обесцвечивается.
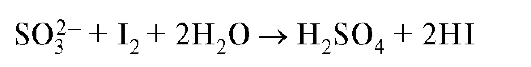
Фосфаты
A. К 1 мл раствора фосфата (0,01-0,03 г иона фосфата), нейтрализованного до рН около 7,0, прибавляют несколько капель раствора серебра нитрата; образуется желтый осадок, растворимый в разведенной азотной кислоте и растворе аммиака.

Б. К 1 мл раствора фосфата (0,01-0,03 г иона фосфата) прибавляют 1 мл раствора аммония хлорида, 1 мл раствора аммиака и 0,5 мл раствора магния сульфата; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах.
Na3PO4 + 3NH4C1 + NH3 Н2О + MgSO4 →
→ NH4MgPO4↓ + 3NaC1 + (NH4)2SO4
B. К 1 мл раствора фосфата (0,01-0,03 г иона фосфата) в разведенной азотной кислоте прибавляют 2 мл раствора аммония молибдата и нагревают; образуется желтый кристаллический осадок, растворимый в растворе аммиака.
H3PO4 + 12(NH4)MoO4 + 21HNO3 →
→ (NH4)3PO4 • 12MoO3↓ + 21NH4NO3 + 12H2O
Хлориды
К 2 мл раствора хлорида (0,002-0,01 г иона хлорида) прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора серебра нитрата; образуется белый творожистый осадок, нерастворимый в разведенной азотной кислоте и растворимый в растворе аммиака. Для солей органических оснований испытание растворимости образовавшегося осадка серебра хлорида проводят после отфильтровывания и промывания осадка водой.
C1- + Ag+ → AgCl↓
Цинк
А. К 2 мл нейтрального раствора соли цинка (0,005-0,02 г иона цинка) прибавляют 0,5 мл раствора натрия сульфида или сероводорода; образуется белый осадок, нерастворимый
в разведенной уксусной кислоте и легко растворимый в разведенной хлороводородной кислоте.
Zn2+ + S2- → ZnS↓
Б. К 2 мл раствора соли цинка (0,005-0,02 г иона цинка) добавляют 0,5 мл раствора калия гексацианоферрата (П); образуется белый осадок, нерастворимый в разведенной хлороводородной кислоте.
3Zn2+ + 2K+ + 2[Fe(CN)6]4- → K2Zn3[Fe(CN)6]2↓
ПРИЛОЖЕНИЕ 5
Не нашли, что искали? Воспользуйтесь поиском: