
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
3 страница. Атомдардың арасында қатаң байланысы бар молекула үшін i молекуланың еркіндік дәрежелерінің санына тең болады.
Атомдардың арасында қатаң байланысы бар молекула үшін i молекуланың еркіндік дәрежелерінің санына тең болады.
Идеал газ молекулалары қашықтықтан әрекеттеспейтін болғандықтан, мұндай газдың ішкі энергиясы жеке молекулалардың энергияларының қосындысынан тұрады. Демек, идеал газдың бір киломолінің ішкі энергиясы Авагадро санын бір молекуланың орташа энергиясына көбейткенге тең болады:
 . (8.13)
. (8.13)
Массасы m газдың ішкі энергиясы газдың бір молінің энергиясын m массадағы киломольдердің санына көбейткенге тең болады:
 . (8.14)
. (8.14)
Сонымен (8.14) өрнектен берілген газдың массасы үшін ішкі энергия газ молекуласының еркіндік дәреже көрсеткіші өзгермейтін болса, оның абсолют температурасына тура пропорционал екендігі көрінеді.
Идеал газдың молекуласының орташа энергиясы (2.5 бап) былай анықталады:  (2.47)
(2.47)
мұндағы  – Больцман тұрақтысы,
– Больцман тұрақтысы,  – газдың температурасы,
– газдың температурасы,  –молекула массасы,
–молекула массасы,  – молекуланың орташа квадраттық жылдамдығы.Бұл теңдеу молекулалары материялық нүктелер және олар тек ілгерілемелі қозғалыста деп есептелетін идеал біратомды газ үшін жазылған. Егер газдың молекулалары бірден көп атомдардан құралған болса, мұндай көпатомды молекула айналмалы және тербелмелі қозға-лыста болуы мүмкін, онда бұл қозғалыстармен байланысты энергияны ескеру қажет.
– молекуланың орташа квадраттық жылдамдығы.Бұл теңдеу молекулалары материялық нүктелер және олар тек ілгерілемелі қозғалыста деп есептелетін идеал біратомды газ үшін жазылған. Егер газдың молекулалары бірден көп атомдардан құралған болса, мұндай көпатомды молекула айналмалы және тербелмелі қозға-лыста болуы мүмкін, онда бұл қозғалыстармен байланысты энергияны ескеру қажет.
Біз алдымен біратомды газды қарастырамыз және оның белгілі массасындағы заттың барлық молекулаларының энергиясын анықтай-тын өрнекті табамыз. Егер газ  молекуладан құралса, онда олардың жалпы
молекуладан құралса, онда олардың жалпы  энергиясы мынаған тең болады:
энергиясы мынаған тең болады:  . (6.2)Бір моль газ үшін (6.2)-ші өрнектің түрі былай жазылады:
. (6.2)Бір моль газ үшін (6.2)-ші өрнектің түрі былай жазылады:  , (6.3)мұндағы
, (6.3)мұндағы 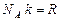 – универсал газ тұрақтысы,
– универсал газ тұрақтысы,  – Авогадро саны.Осы (6.3) өрнекпен анықталатын энергияны идеал газдың (бір молі үшін) ішкі энергиясы деп атайды.Жалпы жағдайда дененің ішкі энергиясы деп, оның құрамындағы молекулаларына қатысты “көзге көрінбейтін” энергиясын айтады. Сондықтан дененің немесе денелер жүйесінің ішкі энергиясы заттың құрамындағы барлық қозғалыстағы молекулаларының кинетикалық энергиясы, молекуланың атомдарының қозғалысының кинетикалық энергиясы (молекула көпатомды болса) мен ондағы молекулалардың өзара әрекеттесуінің потенциалдық энергиясы және атомның құрамы-на кіретін микробөлшектердің кинетикалық және потенциалдық энергиясы да ескерілуі мүмкін. Бірақ, бұған газдың тұтас дене ретіндегі қозғалысының кинетикалық энергиясы және сыртқы күштер өрісінде орналасқандағы потенциалдық энергиясы қосылмайды.Идеал газдың белгілі массасының ішкі энергиясы (6.2) және (6.3) өрнектер бойынша тек температураға тәуелді, газдың қысымы мен көлеміне тәуелді емес. Нақты газдар үшін бұл айтылғандар орындал-майды.Идеал газдың температурасын өзгерту үшін, оның ішкі энергиясын өзгерту керек екендігі, осы (6.2) және (6.3)-ші формуладан көрінеді. Ал механикадан белгілі, энергияның өзгеруі жұмыс істеумен байла-нысты: дененің энергиясы өзгереді, егер дене жұмыс істесе немесе дененің үстінен жұмыс істелсе, онда осы энергия өзгерісі істелген жұмысқа тең болады. Олай болса, газдың немесе кез келген дененің температурасының өзгеруі тек механикалық жұмыс істелгенде байқа-лады деп ойлауға болады. Мәселен, денені қыздыру үшін оның үсті-нен жұмыс істелуі қажет, ал суыту үшін дене өзі жұмыс істеуі керек.
– Авогадро саны.Осы (6.3) өрнекпен анықталатын энергияны идеал газдың (бір молі үшін) ішкі энергиясы деп атайды.Жалпы жағдайда дененің ішкі энергиясы деп, оның құрамындағы молекулаларына қатысты “көзге көрінбейтін” энергиясын айтады. Сондықтан дененің немесе денелер жүйесінің ішкі энергиясы заттың құрамындағы барлық қозғалыстағы молекулаларының кинетикалық энергиясы, молекуланың атомдарының қозғалысының кинетикалық энергиясы (молекула көпатомды болса) мен ондағы молекулалардың өзара әрекеттесуінің потенциалдық энергиясы және атомның құрамы-на кіретін микробөлшектердің кинетикалық және потенциалдық энергиясы да ескерілуі мүмкін. Бірақ, бұған газдың тұтас дене ретіндегі қозғалысының кинетикалық энергиясы және сыртқы күштер өрісінде орналасқандағы потенциалдық энергиясы қосылмайды.Идеал газдың белгілі массасының ішкі энергиясы (6.2) және (6.3) өрнектер бойынша тек температураға тәуелді, газдың қысымы мен көлеміне тәуелді емес. Нақты газдар үшін бұл айтылғандар орындал-майды.Идеал газдың температурасын өзгерту үшін, оның ішкі энергиясын өзгерту керек екендігі, осы (6.2) және (6.3)-ші формуладан көрінеді. Ал механикадан белгілі, энергияның өзгеруі жұмыс істеумен байла-нысты: дененің энергиясы өзгереді, егер дене жұмыс істесе немесе дененің үстінен жұмыс істелсе, онда осы энергия өзгерісі істелген жұмысқа тең болады. Олай болса, газдың немесе кез келген дененің температурасының өзгеруі тек механикалық жұмыс істелгенде байқа-лады деп ойлауға болады. Мәселен, денені қыздыру үшін оның үсті-нен жұмыс істелуі қажет, ал суыту үшін дене өзі жұмыс істеуі керек.
21.Барометрлік формула. Больцманның сыртқы потенциалды өрістегі молекулалар үшін таралу заңы.
Жылулық қозғалыс кезінде бөлшектің қозғалыс бағыттары тең ықтималды, ал әр бөлшектің орнында болатын өзгерістер кездейсоқ сипатқа ие. Сондықтан бөлшектің сол немесе басқа орында болу ықтималдылығы жөнінде айтуға тура келеді.
Идеал газ V көлемді алып тұр және T температурада тепе-теңдік күйде тұр деп айтайық. Сыртқы өріс жоқ кезде кез келген молекуланың орналасуы тең ықтималды. Сондықтан газ барлық көлемде бірдей концентрациямен таралады.
Егер газ сыртқы күш өрісінде орналасқан болса, газ бөлшектері осы өрістің әсеріне ұшырайды. Газдың тығыздығы мен қысымы әр жерде әртүрлі мәнге ие болады. Сыртқы күш өрісі потенциалды және тек бір z бағытында ғана әсер ететін жағдайды қарастырайық. Бөлшектің потенциалдық энергиясын деп белгілейік. Жылулық тепе-теңдік жағдайында сыртқы күш өрісінің әсеріне түскен газ бөлшектерінің концентрациясы
 (8.8)
(8.8)
заңы бойынша өзгереді. Бұл қатынас Больцман заңы деп аталады. Жердің тартылыс өрісін қарастырайық. Жер бетіне жақын жерде молекуланың потенциалдық энергиясы. екенін ескерсек, жер бетінен z биіктіктегі газдың қысымының өрнегін аламыз:
 (8.9)
(8.9)
Бұл өрнек барометрлік формула деп аталады. Оны едәуір сиретілген газдар қоспасы (ауа) үшін де қолдануға болады.
Бұл екі қарастырылған таралуларды Максвелл-Больцман заңы деп біріктіріп қарастыруға да болады. Нақты газдар үшін ол тек бір-бірінен алыс қашықтықтағы молекулалар арасында өзара әсерлесуді ескермеген кезде ғана қолданылады. Өте төмен температураларда (азғындалған газдар аймағы) молекулалардың қозғалысы классикалық заңдарға бағынбайды.
22.Термодинамикалық параметрлер. Тепе-теңдік күй және процестер. Идеал газдың күй теңдеуі. Тепе-тең термодинамикалық процестердегі термодинамикалық диаграммалар. Идеал газдың изопроцестері.
Термодинамиканың параметрлері деп физикалық күйін сипаттайтын физикалық шамаларды айтады.
Денелер жүйесі немесе жай жүйе деп біз қарастырып отырған денелердің жиынтығын айтамыз. Кез келген жүйе температура, қысым, көлем және т.с.с. мәндері арқылы айырылатын әр түрлі күйде бола алады. Жүйенің күйін сипаттайтын осындай шамалар күй параметрлері деп аталады.
Жүйенің тепе-тең күйі деп жүйенің барлық параметрлері, сыртқы жағдайлар өзгермей қалған кезде жеткілікті уақыт бойы тұрақты болып қалатын белгілі мәндерін сақтайтын күйін айтамыз. Тепе-тең күйлердің үздіксіз тізбегінен құралған процесс тепе-тең процесс деп аталады. Тепе-тең күй ұғымы мен қайтымды процесс ұғымы термодинамикада үлкен рөл атқарады.
Изопроцестер: 3: Изотермиялық:Бойль Мариотт заңы T=const идеал газдың берілген массасының қысымының көлеміне көбейтіндісі PV=const T=const m=const тұрақты болып қалады.
тұрақты температурада өтетін процесс (изо-равный, термо-теплый) T=const (тұрақты темпераурада) жұйенің параметрлерінің арасындағы тәуелділікті өрнектейтін графикті айтады.
Изобаралық:Гей Люссак (изобаралық процесс үшін) P=const да идеал газ берілген массасының көлем температурада сызықты өзгереді.  p=const m=const
p=const m=const  ші цельсий бойыншы
ші цельсий бойыншы  газдың көлемі t шкаласы бойынша температура
газдың көлемі t шкаласы бойынша температура 
 Тұрақты қысымда өтетін процесті изобаралық процесс деп атайды.
Тұрақты қысымда өтетін процесті изобаралық процесс деп атайды.
Изохоралық:Шарль заңы Түрақты V=const Идеал газдың берілген массасының қысымы температурадан сызықты өзгереді. Тұрақты көлем кезінде өтетін процесс.
23.Әр түрлі процестердегі идеал газдың атқарған жұмысын есептеу.
Денені тұрақты көлемде қыздырғанда барлық жылу ішкі энергияны арттыруға жұмсалады, бір кило моль үшін  . P=const жылу мөлшері ішкі энергияны арттыруымен қатар дененің көлемін ұлғайтуға қажетті жұмысқа жұмсалады
. P=const жылу мөлшері ішкі энергияны арттыруымен қатар дененің көлемін ұлғайтуға қажетті жұмысқа жұмсалады 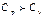 ,
, 
Изохора A=0. Изобара  . Изотерма
. Изотерма 

Адиабаталық  ,
,  ,
,  . Политропты
. Политропты  ,
, 
24.Термодинамиканың бірінші бастамасы және оны идеал газдың изопроцестеріне қолдану.
Термодинамиканың параметрлері деп физикалық күйін сипаттайтын физикалық шамаларды айтады.
Жүйенің ішкі энергиясымолекулалардың ретсіз қозғалысының кинетикалық энергиясы, молекулалардың өзара әсерлесуінші потенциялық энергиясы және ішкі молекулалық энергиясы кіреді. Ішкі энергия жүйе күйінің функциясы болып табылады.
Жүйеге істелген жұмыс (А)сыртқы денелердің жұйеге берген энергиясы.
Жылу мөлшері (Q) жылу алмасу процесінде сыртқы денелердіжүйеге беретін энергиясы.
Ішкі энергия негізінен екі түрлі процесте өзгереді: дененің немесе денеге қарсы сыртқы күштің А жұмыс істеуімен және денеге беретін немесе алынатын Q жылу мөлшері есебінен.
Тепе теңдік күйлер сыртқы орта өзгермеген жағдайда жүйенің параметрлік мәндері қанша қажет болса, сонша тұрақты болып қалатын күйді айтады.
Изопроцестер: 3
Изотермиялық: Бойль Мариотт заңы T=const идеал газдың берілген массасының қысымының көлеміне көбейтіндісі PV=const T=const m=const тұрақты болып қалады.
тұрақты температурада өтетін процесс (изо-равный, термо-теплый) T=const (тұрақты темпераурада) жұйенің параметрлерінің арасындағы тәуелділікті өрнектейтін графикті айтады.
Изобаралық: Гей Люссак (изобаралық процесс үшін) P=const да идеал газ берілген массасының көлем температурада сызықты өзгереді. p=const m=const ші цельсий бойыншы газдың көлемі t шкаласы бойынша температура Тұрақты қысымда өтетін процесті изобаралық процесс деп атайды.
Изохоралық: Шарль заңы Түрақты V=const Идеал газдың берілген массасының қысымы температурадан сызықты өзгереді. Тұрақты көлем кезінде өтетін процесс.
Термодинамиканың бірінші бастамасы жүйеге берілген жылу мөлшері жүйенің ішкі энергиясының өсімшесіне және жүйенің сыртқы денелерде атқаратың жұмысына тең.Егер Q>0 жылу беріледі,Q<0 жүйеден жылу алынады,Q=0 адибаталық процесс.
Жүйе параметрлерінің аз ғана өзгерісіне сәйкес келетін термодинамиканың І бастамасы мынадай түрде жазылады..
Мұндағы элементар жылу мен жұмысы.dU жүйенің ішкі энергиясының өсімшесі.
Идеал газдың изопроцестеріне қолдану
Изохора
Изобара
Изотерма
Термодинамикның бірінші бастамасы Термодинамикада макраскопиялық денелердің жылулық қасиеттері олардың микроскопиялық табиғатымен байланыстырылмай, көптеген тәжірибелер арқылы анықталған, бастамалар деп аталтын негізгі үш заңға сүйеніп зерттеледі. Термодинамиканың бірінші бастамасы энергияның сақталу және түрлену заңдарын сипаттайды.
25.Адиабаталық процесс. Адиабаталық процесс үшін термодинамиканың бірінші заңы. Пуассон теңдеуі. Адиабата көрсеткіші.
Адиабаталық процесс деп жүйе мен оны қоршаған сыртқы ортаның арасында ешқандай жылу энергиясының алмасуы болмайтын процесті айтамыз.
Енді термодинамиканың бірінші бастамасын ескере отырып, адиабаталық процесс кезінде газдың параметрлерін байланыстыратын теңдеуді табайық. Заттың жылу сыйымдылығы адиабаталық процесте нольге тең болады, 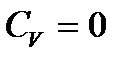 . Олай болса, термодинамиканың бірінші бастамасы
. Олай болса, термодинамиканың бірінші бастамасы
dA = dU, (6.15)
сөйтіп, сыртқы күштерге қарсы істелген жұмыс жүйенің ішкі энергиясының өзгеру әсерінен пайда болады. Бұдан адиабаталық процестің изотермалық процеске қарсы өтетінін байқаймыз. Егер (79) теңдеуге 15 – параграфтағы мәндерін қойсақ, адиабаталық үрдіс теңдеуін газ күйі теңдеуін, Майер теңдеуін ескеріп шығарып алуға болады:
 (6.16)
(6.16)
Осы табылған өрнек адиабаталық процесс кезіндегі газ күйінің теңдеуі немесе Пуассон теңдеуі деп аталады. (16) теңдеудегі γ өлшемсіз шама (адиабата көрсеткіші):
 (6.17)
(6.17)
Ол Пуассон коэффициенті болып есептеледі.
Адиабаталық процестің pV координаттарындағы диаграммасы гипербола қисығымен кескінделеді (12 - сурет). сонымен адиабата қисығының теңдеуі

болса, изотерма қисығының теңдеуі pV = const. 3 – суреттен адиабата қисығы изотерма қисығына қарағанда тіктеу екенін көреміз.
Адиабаталық үрдіс кезінде істейтін жұмысты мына түрде жазуға болады:
 (6.18)
(6.18)
26. Қайтымды және қайтымсыз процестер.Термодинамиканың екінші заңы. Қайтымды процесс кері бағытта өткізуге болатын процесті тура бағытта өткізгенде жүйе қандай күйлерден өтсе, кері бағытта сондай тізбегінен өтетін процесті айтады. Қайтымды процеске тек тепе тең процестер жатады. Қайтымды процесте жүйені қоршаған денелерде ешқандай өзгеріс болмайды. Қайтымсыз процестер өздігінен бір бағытта өтетін процес. Нақты процестер қайтымсыз процестер болады. Олар мейлінше баяу өте отырып, қайтымды процестерге тек жуықтай алады. Қайтымды процеске мысал ретінде вакумдегі абсолют серпімді серіппеге ілінген дененің өлшейтің тербелісің алуға болады. Кедергісі бар ортада өтетін процестердің барлығы қайтымды процестер. Қайтымсыз процестерге температуралары әр түрлі денелердің бір біріне жылу алмасу салдарынан температуралары тенелу процесі жатады, себебі жылу ыстық денеден салқынға беріледі, керісінше болу мүмкін емес. Т ермодинамиканың ІІ бастамасы термодинамикалық процестердің қайтымсыздығын тұжырымдайды.
-тек қана жұмыс өндіретін немесе бір жылулық резервуармен энергия алмасуын жасайтын циклдік процесс болуы мұмкін емес (У.Томсон);
- салқын денеден ыстық денеге жылу берілуі мүмкін болатын циклдік процесс болуы мүмкін емес (Р.Клаузиус).
27.Жылу машиналары. Жылу машинасының термиялық ПӘК-і. Карно циклі. Карно теоремасы Тарихи түрғыдан алған кезде термодинамиканың екінші бастамасының жылпылама түжырымдамасын тағайындау жылу двигателдерін (немесе, ескі атымен атасақ, жылу машиналарын) зерттеу үстінде жүрді. Жылу машинасы дегеніміз жылу энергиясын механикалық жүмысқа айналдыратын қондырғы.Кез-келген жьтлу машинасының непзінде, егер де жылуға температурасы жоғары болатын жер-ден температурасы томенірек болатык жерге өтуге мүмкіндік берілсе, онда механикалық энергия алуға болады деген идея жатыр, ері осы процесс кезінде жылудың бІр мөлшерін механикалық жүмысқа айналдыруға болады. Бүл жағдай жобалық түрде суретте көрсетілген. Жоғарғы Т1,жөне томенгі Т2 температураларды жылу машинасының жүмыс пгемпературалары деп атайды; бүл температураларды түрақты Т1 және Т2 температураларда болатын екі термостат қамтамасыз етеді деп санаймыз. Біз тек жүмыс циклдерін перяодтык түрде кайталап отыратын жылумашиналарын гана қарастыратын боламыз (яғии, система түгелдей период-ты түрде бастапқы күйге қайтып оралып отырады), демек, олар үздіксіз жүмыс атқаратын болады. Машинаның жүмыс атқаруы процесі кезінде қыздырыла-тын және салқындатылатын зат жүмысшы дене деп аталады. Температурасы Т} болатын жэне жылу мөлшерін берІп отыратын термостатты қыздырғыш, ал температурасы Т2 болатын және жылудың белгілі мөлшерін қабыл-даи отыратьтн термостатты суыткыш деп атайды.
Егер дененІң (жүйенің) күйі оньгң қысымы мен келемі арқылы сипатталатын болса, онда оның күйі рV диаграммадагы графикте нүкте түрінде өрнектеледі. Мүндай диаграммада күйдің озгерісі сызық түрінде өрнектеледі. Дөңгелек процесс мүндай диаграммада тұйық сызықпен (мысалға, АаВвА сызығы) беріледі. Цикл ішінде атқарылатын жұмыс осы түйық сызық қамтитын ауданға тең болады.
Карно циклы 4 қайтымды процестен тұрады:2 изотермадан,2 адиабатадан. Циклді жүзеге асыру үшін, жылулық дене (газ), суытқыш және қыздырғыш болуы тиіс.Q жылу мөлшері газ бірінші күйден екінші күйге изотермиялық түрде өткенде:  .
.
Адиабаталық ұлғаю барысында газ 2ші күйден 3ші күйге өткенде: 
Изотермдік сығылғанда: 
Адиабаталық сығылу 4тен 1ге  Адиабаттық ұлғаю және сығылу үшін теңдіктері
Адиабаттық ұлғаю және сығылу үшін теңдіктері  ,
,

.Қайтымсыз машиналардың пәкі қайтымды машиналардың пәкінен кіші
 . Бұдан
. Бұдан  . Бұл қатынас Клаузиус теңсіздігі ал Q/T қатынас келтірілген жылу мөлшері деп аталады. Клаузиус тенсіздігінен: егер бір жүйеде цикл жасалып, соның барысында температуралары тұрақты болатын екі жылу резервуарларымен жылу алмасатын болса, келтірілген жылу мөлшерінің қосындысы, цикл қайтымды болған жағдайда нольге тең, ал қайтымсыз болғанда нөлден кіші болады.
. Бұл қатынас Клаузиус теңсіздігі ал Q/T қатынас келтірілген жылу мөлшері деп аталады. Клаузиус тенсіздігінен: егер бір жүйеде цикл жасалып, соның барысында температуралары тұрақты болатын екі жылу резервуарларымен жылу алмасатын болса, келтірілген жылу мөлшерінің қосындысы, цикл қайтымды болған жағдайда нольге тең, ал қайтымсыз болғанда нөлден кіші болады.
28.Энтропия – күй функциясы. Энтропияның мағынасы және қасиеттері Энтропия (грек. еntropіa – бұрылыс, айналу) – тұйық термодинамикалық жүйедегі өздігінен жүретін процестің өту бағытын сипаттайтын күй функциясы. Энтропияның күй функциясы екендігі термодинамиканың екінші бастамасында тұжырымдалады. Энтропия ұғымын термодинамикаға 1865 ж. Р.Клаузиус енгізген. Энтропия термодинамикалық жүйенің сыртқы ортамен жылу алмасу және өздігінен өшетін процестердің өту бағытын сипаттайтын шама.  ,
,  . Ішкі энергия сияқты Энтропия процестін жүріа өтетің жолына байланысты емес кез келген процесте бастапқы күйіне келетің болса, онда Энтропияның толық өзгеруі нөлге тең.
. Ішкі энергия сияқты Энтропия процестін жүріа өтетің жолына байланысты емес кез келген процесте бастапқы күйіне келетің болса, онда Энтропияның толық өзгеруі нөлге тең.  .
.
Қайтымсыз процесте онашаланған жүйенің энтропиясы артады және процестер Энтропия артатын жаққа бағытталады  .
.
Қайтымды процестерде онашаланған жүйенің энтропиясы  , өзгермейді S=const және изоинтропиялық процесд.а. Егер жүйе онашаланбай сыртқы ортаға жылу беретін болса, Энтропия азаяды.
, өзгермейді S=const және изоинтропиялық процесд.а. Егер жүйе онашаланбай сыртқы ортаға жылу беретін болса, Энтропия азаяды.
Энтропия жүйені құрайтын бөлшектердін бей берекетсіздігінің өлшемі.
Изотермиялық 
Изохоралық 
Изобаралық 
Адиабаталық  , S=const
, S=const
Энтропияның күй ықтималдығымен байланысы S=klnW
30.Электр заряды және оның қасиеттері.Электр зарядының сақталу заңы.Электр зарядының әсерлесуі. Кулон заңы. Электр өрісі. Электр өрісінің кернеулігі
Электр заряды денелердің электрлік әсерлесуін сипаттайды. Электр зарядтарының қасиеттері:
- электр зарядтары оң және теріс болады, аттас зарядтар бір-бірінен тебіледі, ал әр аттас зарядтар бір-біріне тартылады;
- электр заряды релятивтік - инвариантты: ол қозғалыс кезінде мәнін
өзгертпейді, яғни оның шамасы санақ жүйесіне тәуелсіз;
- электр заряды аддитивті, яғни кез-келген жүйенің заряды жүйені
құрайтын бөлшектердің зарядтарының алгебралық қосындысына тең;
- электр заряды дискретті, яғни кез келген бөлшек е элементар зарядтан тұрады, яғни: q= eN.
Элементар заряды бар бөлшектер электрон (теріс) және протон (оң),
Элементар заряд / е/ = 1,6 10-19 Кл.
Электр зарядының сақталу заңы - тұйықталған жүйенің электр заряды осы жүйеде өтетін кез келген процесс кезінде өзгермейді. q1 + q2 + q3+ ….+ qn = const
Нүктелік заряд деген өлшемі мен пішінін ескермеуге болатын электр заряды бар дене.
Зарядтың сақталу заңы – кез келген тұйық жүйенің (электрлік оқшауланған) электр зарядтарының алгебралық қосындысының өзгермейтіндігі (сол жүйе ішінде қандай да бір процестер жүрсе де) туралы табиғаттың іргелі дәл заңдарының бірі.
Не нашли, что искали? Воспользуйтесь поиском: