
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Глубинное, или осаждающее, раскисление
Этот метод заключается в переводе растворенного в стали кислорода в нерастворимый оксид путем введения в металл определенного элемента-раскислителя. Элемент-раскислитель должен иметь большее химическое сродство к кислороду, чем железо. В результате реакции образуется малорастворимый в металле оксид, плотность которого меньше плотности стали. Полученный таким образом «осадок» всплывает в шлак (отсюда название метода «осаждающий»). Этот метод раскисления часто также называют «глубинным», так как раскислители вводят в глубину металла. В качестве раскислителей обычно применяют марганец (в виде ферромарганца), кремний (в виде ферросилиция), алюминий, сплавы РЗМ (цезия, лантана и др.) и ЩЗМ.
Раскисление осуществляется по следующим реакциям:
[Мn] + [О] = (МnО),
[Si] + 2[0] =(SiO2),
2[А1] + 3[O]=А12O3(ТВ),
2[Се] + 3[О] = Се2Оз(ТВ) и т.д.
Все эти реакции идут с выделением тепла. Равновесие реакции осаждающего раскисления сдвигается влево при повышении и вправо при понижении температуры. Практически это означает, что по мере понижения температуры стали (при ее кристаллизации в изложнице или в литейной форме) реакции раскисления продолжают идти и образуются все новые и новые количества оксидов, которые не успевают всплыть и удалиться из металла. В связи с этим при данном методе раскисления невозможно получить сталь, совершенно чистую от неметаллических включений, что является его недостатком. Однако этот метод получил широкое распространение как наиболее простой и дешевый.
При введении в металл элемента-раскислителя активность растворенного в металле кислорода уменьшается. Активность кислорода, соответствующая определенной концентрации элемента-раскислителя, при которой он находится в равновесии с кислородом при данной температуре, называется раскислительной способностью элемента-раскислителя. При изменении температуры раскислительная способность изменяется, иногда очень существенно. Обычно сравнение элементов-раскислителей по их раскислительным способностям проводят при 1600 °С.
В общем случае реакция глубинного, или осаждающего, раскисления имеет вид


где R — условное обозначение элемента-раскислителя.
При раскислении обычно имеют дело с очень малыми значениями концентраций элемента-раскислителя [R]и кислорода [О], поэтому


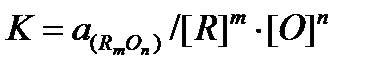
Если в результате реакции образуется чистый оксид  то
то 
и  или
или  . Значения произведения равновесных концентраций раскислителя и кислорода удобны для сравнения раскислительной способности используемых элементов. Графически эти соотношения часто представляют в логарифмических или полулогарифмических координатах (рис. 22). Если
. Значения произведения равновесных концентраций раскислителя и кислорода удобны для сравнения раскислительной способности используемых элементов. Графически эти соотношения часто представляют в логарифмических или полулогарифмических координатах (рис. 22). Если  то
то

откуда
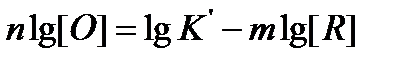

Рис. 21. Раскислительная способность элементов R в чистом железе (а) и влияние растворенных элементов на активность кислорода (б)
т. е. в логарифмических координатах зависимость [О] от [R]должна быть выражена прямой линией. Если эта линия криволинейна или на ней имеется перелом, значит, изменяется состав продуктов раскисления. Так, например, при низких концентрациях углерода продуктами реакции раскисления являются СО и СО2; при раскислении кремнием состав продуктов раскисления по мере повышения концентрации кремния изменяется:
(FeO)2·SiО2 → (FеО)n·(SiO2)→SiO2→SiO
при взаимодействии кислорода с хромом состав образующихся продуктов по мере повышения концентрации хрома также изменяется:
FeO·Сr2О3→ Сr2О3 → Сr и т. д.
Значения раскислительной способности отдельных раскислителей, по разным данным, часто существенно расходятся. Это объясняется тем, что практически при любом способе производства стали существует какой-то внешний источник поступления кислорода и этот кислород оказывает определенное влияние на протекание реакции раскисления. Например, реакцию раскисления алюминием записывают обычно в виде
2[О]+3[А1]=А12О3. Однако, если в газовой среде присутствует кислород, необходимо учитывать и возможность образования соединений типа FеА12О4 (герцинит):
Fеж+1/2O2(г)+2А12O3= FеА12О4+2[А1]+3[О].
Полученные при этом численные значения раскислительной способности алюминия зависят от парциального давления кислорода  .В большинстве случаев образующиеся при раскислении оксиды для упрощения обозначают MnO, SiO2, A12O3 и т. д.
.В большинстве случаев образующиеся при раскислении оксиды для упрощения обозначают MnO, SiO2, A12O3 и т. д.
Не нашли, что искали? Воспользуйтесь поиском: