
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства комплексных соединений
При обычных условиях большинство комплексных соединений имеют кристаллическое строение. Наличие заряда у внутренней сферы и противоположно заряженные ионы внешней сферы придают комплексным соединениям большое сходство с обычными солями. Поэтому очень важным свойством комплексных соединений является их способность растворяться в воде и в других полярных растворителях. При этом комплексные соединения диссоциируют по механизму сильных электролитов: разрыв ионной связи между комплексным ионом и ионами внешней сферы.


 Первичная диссоциация комплексного соединения – это распад комплексного соединения в растворе на комплексный ион внутренней сферы ионы внешней сферы:
Первичная диссоциация комплексного соединения – это распад комплексного соединения в растворе на комплексный ион внутренней сферы ионы внешней сферы:
 K[Fe(H2O)2(CN)4] ↔ К+ + [Fe(H2O)2(CN)4]-
K[Fe(H2O)2(CN)4] ↔ К+ + [Fe(H2O)2(CN)4]-
[ Сu(NH3)4 ] Cl2 ↔ [ Сu(NH3)4 ]2+ + 2Cl-.
В растворах комплексные соединения вступают в реакции ионного обмена (см. п.. 7.5.), характерные для солей (см. п. 2.3.).
Вторичная диссоциация комплексного соединения - это распад внутренней сферы комплекса на составляющие его компоненты:
 [ Сu(NH3)4 ] 2+ ↔ Сu2+ + 4NH3↑.
[ Сu(NH3)4 ] 2+ ↔ Сu2+ + 4NH3↑.
Вторичная диссоциация связана с разрывом ковалентной связи между комплексообразователем и лигандами, поэтому она сильно затруднена и имеет равновесный характер подобно диссоциации слабого электролита. Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, называемую константой нестойкости комплекса (Кнест). Для комплексного иона [ Сu(NH3)4 ] 2+ выражение константы нестойкости имеет вид:
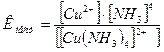 . (8.1.)
. (8.1.)
Значения констант нестойкости комплексных ионов приведены в Приложении (табл.6).
Чем меньше величина Кнест , тем устойчивее комплексный ион. Устойчивость комплексных соединений зависит от природы центрального атома, степени его окисления, координационного числа, от соотношения между размерами комплексообразователя и лигандов.
Нейтральные комплексные соединения - неэлектролиты, в водных растворах не диссоциируют.
 Задачи и упражнения
Задачи и упражнения
Пример 1. Назовите следующее комплексное соединение K3[Co(NO2)6]. Определить в нём заряд иона-комплексообразователя и координационное число.
Решение:
1. Исходя из химической формулы, можно определить заряд внутренней сферы, которая связана с тремя ионами К+. Следовательно: [Co(NO2)6]3-.
Координационное число – 6.
Лиганд в данном комплексе – кислотный остаток NO2-.
Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов, следовательно:
Заряд иона-комплексобразователя равен заряду внутренней сферы минус сумма зарядов лигандов: -3 - 6·(-1) = +3, т.е. Со3+.
2. K3[Co(NO2)6] – гексанитрокобальтат(III) калия
Пример 2. Написать уравнения первичной диссоциации комплексного соединения [Ni(NH3)6]SO4.
Решение: [Ni(NH3)6]SO4 ↔ [Ni(NH3)6]2+ + SO42-.
Пример 3. Написать уравнение вторичной диссоциации и формулу константы нестойкости комплексного иона тетрахлороаурата (III).
Решение
1. По названию составим формулу комплексного иона: [AuCl4]-.
2. Уравнение диссоциации этого иона: [AuCl4]- ↔ Au3+ + 4Cl-.
3. Константа нестойкости этого иона:
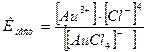 .
.
Вопросы для самопроверки
1. Какие соединения называются комплексными?
2. Какие частицы могут выполнять роль лиганда?
3. Что такое координационное число и как его значение связано с зарядом иона-комплексообразователя?
4. Какие химические элементы могут выполнять роль комплексообразователя?
5. Что такое константа нестойкости и что она характеризует?
6. В каком случае внутренняя сфера будет анионом?
Не нашли, что искали? Воспользуйтесь поиском: