
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Ысым. Газдардың молекула-кинетикалық теориясының негізгі теңдеуі
Газ осы өзі орналасқан кез келген ыдыстың кабырғасына кысым түсіреді. Газ молекулалары үлкен жылдамдықпен ретсіз қозғалып жүретіні белгілі. Сонда олар бір-бірімен әрі өзі тұрған ыдыстың қабырғаларымен соқтығысады. Газдың молекулалары өте көп, сондықтан олардың соқтығысу саны да көп. Қысымның барлык бағытта бірдей болуы газдарға тән қасиет және Бұл орасан көп молекулалардын ретсіз козғалысының нәтижесі болып табылады. Газ молекулалары ыдыс қабырғасына неғұрлым жиі соктығысса, газдың ыдыс кабырғасына түсіретін қысымы соғұрлым үлкен болатыны айқын.
ОХ бағытында перпендикуляр  бетке газдың түсір-ген p қысымы былай анықталады:
бетке газдың түсір-ген p қысымы былай анықталады:
 . (1)
. (1)
Әр молекуланың  жылдамдығы оның координаттар осьтеріне қатысты құраушылары арқылы былай жазылады:
жылдамдығы оның координаттар осьтеріне қатысты құраушылары арқылы былай жазылады:  , сондықтан
, сондықтан
 (2)
(2)
 .
.
 . (3)
. (3)
(2)-ші формула бойынша анықталған  мәнін (1)-шы өрнекте алмастырып, өте маңызды формуланы аламыз:
мәнін (1)-шы өрнекте алмастырып, өте маңызды формуланы аламыз:
 . (4)
. (4)
(4) теңдеу элементар молекула-кинетикалық теорияның негізгі теңдеуі деп аталады.
Газдың қысымын молекулалардың орасан зор жиынтығымен, олардың ыдыс қабырғасы мен өзара әсерлерінің қосынды нәтижесімен байланысты шама. Молекула –кинетикалық теорияның негізгі қағидалары:
1. Барлық заттар бөлшектерден тұрады (молекулалар мен атомдардан);
2. Осы бөлшектер тәртіпсіз, хаостық қозғалыста болады. Бұл қозғалыс жылулық қозғалыс деп аталады;
3. Бөлшектер бір-бірімен өзара әсерлеседі.
Зат бөлшектерінің жылулық қозғалысын қөрнекі түрде көрсететін тәжірибені ағылшын ғалымы Броун жасады. Броун микроскоптың көмегімен сұйықта қалқыған гүл тозаңдарының жылдам, тәртіпсіз қозғалысын бақылады. Осындай зат бөлшектерінің жылулық қозғалысын Броундық қозғалыс деп атайды.
2. Бір және кез-келген моль үшін Клапейрон-Менделеев теңдеуі. Идеал газдың шартты үлгісі.
 (1)
(1)
Егер газдың массасы өзгермесе,  тұрақты болады, онда p қысым
тұрақты болады, онда p қысым  температураға пропорционал.
температураға пропорционал.
Егер 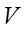 көлемде
көлемде  молекула болса, онда
молекула болса, онда  , осыныескеріп
, осыныескеріп
 немесе
немесе 
 , сондықтан
, сондықтан 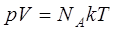
 .
.
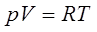 Менделеев-Клапейрон теңдеуі
Менделеев-Клапейрон теңдеуі
Ал газдың кез келген m массасы үшін күй теңдеуі былай анықталады. 
өрнектегі газдың N молекулалар санын, мольдің анықтамасын қолданып, былай жазамыз 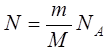 .
.
 ;
;  ->
->  немесе
немесе  осы өрнек идеал газдың кез келген m массасы үшін жазылған күй теңдеуі.
осы өрнек идеал газдың кез келген m массасы үшін жазылған күй теңдеуі.
3. Изопроцестер (осы процестегі теңдеуі, графигі, жұмысы)
Термодинамикалық процесс деп қарастырылатын термодинамикалық жүйенің параметрлерінің өзгеруімен сипатталатын жүйенің күйінің өзгеруін айтады.
Берілген жағдайда атомдарының арасындағы өзара әсерлесу күші елеусіз аз болатын газды идеал газ деп атайды.
Қалыпты жағдайдағы газдарды идеал газ деп есептеуге болады. Термодинамикалық параметрлер арасындағы байланысты анықтайтын теңдеуді күй теңдеуі деп атайды.
 .
.
1. Изотермиялық процесс:
Тұрақты температурада өтетін процесс изотермиялық процесс деп аталады.
 .
.
Изотермиялық процесті сипаттайтын заңды ағылшын ғалымы Бойль мен француз ғалымы Мариот бір-бірінен тәуелсіз, тәжірибе жүзінде алды. Сондықтан бұл заң Бойль-Мариот заңыдепаталады.
Берілген газдың массасы үшін тұрақты температурада газ қысымының көлемге көбейтіндісі тұрақты болады.
 немесе
немесе 

Изотермиялық процесті сипаттайтын графикті изотерма деп атайды. Графикте Т1<Т2.
2. Изобаралық процесс:
Тұрақты қысымда өтетін процесс изобаралық процесс деп аталады.
 .
.
Изобаралық процесті сипаттайтын заңды француз ғалымы Гей-Люссак тәжірибе жүзінде алды. Сондықтан бұл заң Гей-Люссак заңыдепаталады.
Берілген газдың массасы үшін тұрақты қысымда газ көлемінің температураға қатынасы тұрақты болады.
 немесе
немесе  .
.
Гей-Люссак заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:

мұндағы: 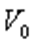 -
-  температурадағы газ көлемі,
температурадағы газ көлемі,  -
-  температурадағы газ көлемі,
температурадағы газ көлемі,  - газ көлемінің ұлғаюының температуралық коэффициенті.
- газ көлемінің ұлғаюының температуралық коэффициенті.

Изобаралық процесті сипаттайтын графикті изобара деп атайды. Графикте р1<р2.
3. Изохоралық процесс:
Тұрақты көлемде өтетін процес изохоралық процесс деп аталады.
 .
.
Изохоралық процесті сипаттайтын заңды француз ғалымы Шарль тәжірибе жүзінде алды. Сондықтан бұл заң Шарль заңыдепаталады.
Берілген газдың массасы үшін тұрақты көлемде газ қысымының температураға қатынасы тұрақты болады.
 немесе
немесе  .
.
Шарль заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
 ,
,
мұндағы: 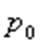 -
- 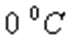 температурадағы газ қысымы,
температурадағы газ қысымы,  -
- 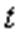 температурадағы газ қысымы,
температурадағы газ қысымы,  - газ қысымының температуралық коэффициенті.
- газ қысымының температуралық коэффициенті.

Изохоралық процесті сипаттайтын графикті изохора деп атайды. Графикте V1<V2.
Не нашли, что искали? Воспользуйтесь поиском: