
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Упорядоченная вторичная структура
a-Спираль
К основным параметрам характеризующим a-спирализацию полипептидных цепей относятся следующие:
1. a-Спираль стабилизируется водородными связями между атомами водорода NH-группы пептидной связи и карбонильным кислородом аминокислотного остатка, отстоящего от данной пептидной группы на четыре позиции вдоль цепи (рис. 2.3).

Рис. 2.3. Принцип образования водородных связей в a-спирали.
2. На один виток a-спирали приходится 3,6 аминокислотных остатка и шаг спирали составляет 0,54 нм.
3. В образовании водородных связей участвуют все атомы водорода NH-групп и атомы карбонильного кислорода пептидных связей, что обеспечивает максимальную стабильность a-спирали и в значительной степени снижает гидрофильность a-спирализованных участков.
4. a-Спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии.
5. Правосторонняя a-спираль (рис. 2.4), обычно обнаруживаемая в белках, отличается намного большей стабильностью, чем левосторонняя.
6. Стабильность a-спирали в значительной степени зависит от аминокислотного состава соответствующего участка полипептидной цепи (таблица 4).

Рис. 2.4. Архитектура a-спирали. Вид сбоку (а, б) и вид сверху (в).
Таблица 4. Влияние различных аминокислот на формирование a-спирали.
| Стабилизируют | Дестабилизируют | Препятствуют |
| Ala | Arg | Pro |
| Asn | Asp | Hyp |
| Cys | Glu | |
| Gln | Gly | |
| His | Lys | |
| Leu | Ile | |
| Met | Ser | |
| Phe | Thr | |
| Trp | ||
| Tyr | ||
| Val |
В некоторых белках степень a-спирализованности может достигать практически 100%, другие белки вовсе лишены a-спиралей. К факторам, которые препятствуют образованию a-спиралей относят расположение подряд нескольких одноименно заряженных аминокислотных остатков (электростатическое взаимное отталкивание), или аминокислот с объемными боковыми R-группами (пространственное несоответствие). Некоторые аминокислоты в силу структурных особенной своих боковых радикалов не способны принимать участие в формировании a-спирали, благодаря чему в месте их расположения непрерывность a-спирали нарушается. К таким аминокислотам относится пролин (атом азота пролина является частью жесткой кольцевой структуры, и вращение вокруг связи С—N в кольце становится невозможным).
Складчатый b-слой
Альтернативная упорядоченная вторичная структура белка – складчатый b-слой – была предложена Полингом и Кори. В то время как в a-спирали полипептидная цепь находится в конденсированном состоянии, в складчатом b-слое цепи почти полностью вытянуты (рис. 5). В тех случаях, когда соседние полипептидные цепи складчатого b-слоя идут в противоположных направлениях (за положительное принимается направление от N- к С-концу), структуру называют антипараллельной. Когда соседние цепи идут в одном направлении, структуру b-слоя называют параллельной (рис. 2.5).
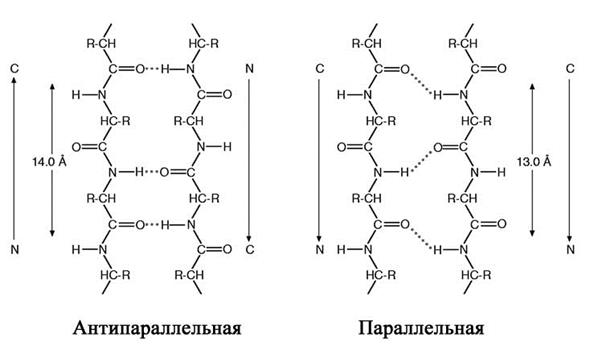
Рис. 2.5. Принципы организации антипараллельного и параллельного складчатого b-слоя.
Области складчатой b-структуры присутствуют во многих белках, причем встречается как параллельная, так и антипараллельная формы. В формировании таких структур могут участвовать от двух до пяти соседних полипептидных цепей. Во многих белках одновременно присутствуют и a-спирали, и складчатая b-структура.
Не нашли, что искали? Воспользуйтесь поиском: