
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Третичная структура. Третичной структурой белковых молекул называется трехмерная пространственная организация белка, формирующаяся и стабилизирующаяся за счет многих и различных
Третичной структурой белковых молекул называется трехмерная пространственная организация белка, формирующаяся и стабилизирующаяся за счет многих и различных по природе слабых взаимодействий между остатками аминокислот, которые могут располагаться на значительном расстоянии друг от друга в составе полипептидной цепи. К таким взаимодействиям относятся солевые мостики, водородные связи, гидрофобные взаимодействия, а также ковалентные дисульфидные связи (рис. 2.6).
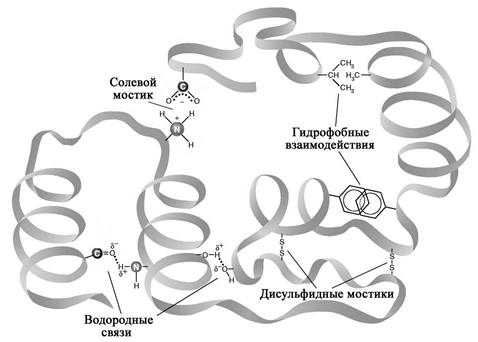
Рис. 2.6. Связи и взаимодействия в третичной структуре белка.
Гидрофобные взаимодействия. Неполярные молекулы или части молекул не способные взаимодействовать с водой называются гидрофобными. К гидрофобным группам относятся алкильные и арильные (ароматические) радикалы ряда аминокислот. Гидрофобные радикалы аминокислотных остатков избегают контактов с водным окружением и стремятся собраться вместе внутри глобулярной структуры, где они формируют гидрофобное ядро.
Электростатические взаимодействия. К ним относятся ион-ионные, ион-дипольные и диполь-дипольные взаимодействия. Эти ионные связи возникают между разноименно заряженными группами боковых цепей аминокислот. Например, при физиологических значениях рН e-аминогруппа лизина несет заряд +1, а карбоксильная группа глутаминовой кислоты в составе боковой цепи несет заряд -1. Следовательно, боковые радикалы указанных аминокислот способны взаимодействовать друг с другом электростатически, дополнительно стабилизируя структуру белка, за счет образования солевых мостиков.
Дисульфидные мостики. Третичная структура ряда белков может стабилизироваться дисульфидными мостиками (—S— S—), образующимися за счет ковалентного взаимодействия SH-групп двух остатков цистеина (рис. 2.7). Принимающие участие в образовании (—S—S—)-мостиков остатки цистеинов могут быть линейно существенно разобщены в полипептидной цепи, однако при формировании третичной структуры SH-группы таких остатков цистеина оказываются пространственно сближенными и ковалентно сшивают два участка одной полипептидной цепи (или соседних цепей).

Рис. 2.7. Связи и взаимодействия в третичной структуре белка.
Водородные связи. В отличие от водородных связей поддерживающих вторичные структуры белков, водородные связи, участвующие в стабилизации третичной структуры более разнообразны (рис. 2.8). В этом случае водородные связи образуются:
- между боковыми R-группами аминокислот;
- между карбонильными атомами кислорода и атомами амидного водорода, принадлежащими пептидным группам остова;
- между поверхностными остатками полярных аминокислот белка и молекулами воды, расположенными в соседних петлях полипептидной цепи;
- между, например, гидроксильной группой остатка серина в одном участке полипептидной цепи и атомом азота в кольце остатка гистидина, находящегося в соседней петле той же цепи;
- между амидной группой глутамина в одном участке полипептидной цепи и остатком тирозина в другом участке.


Рис. 2.8. Различные варианты формирования водородных связей в третичной структуре белка.
Не нашли, что искали? Воспользуйтесь поиском: