
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема №4. Галогены и их соединения с щелочными металлами.
6.2. Цель Ознакомление студентов со свойствами и с методологией оценки качества лекарственных препаратов на основе галогенов и их соединений с щелочными металлами.
Тезисы лекции
Среди элементов седьмой группы периодической системы главную подгруппу составляют водород и галогены: фтор, хлор, бром, йод и астат. Первые четыре галогена встречаются в природе. Астат получен искусственным путем и неустойчив (радиоактивен). Фтор, бром и йод в числе 15 микроэлементов входят в- состав нашего организма.
В молекулярной форме ни один из галогенов в природе не- встречается, так как их молекулы имеют очень высокую реакционную способность.
В большинстве своих соединений галогены одновалентны. Это объясняется их электронной конфигурацией.
На внешнем электронном слое атомы галогенов имеют 7 электронов (2 на s- и 5 на р-орбиталях) и поэтому проявляют большую склонность к присоединению еще одного электрона и- образованию однозарядных отрицательных ионов с конфигурацией соответствующего инертного газа (ns2np6). Следовательно, в химическом отношении галогены проявляют себя как неметаллы и являются окислителями. В этом отношении наиболее энергично притягивает электрон фтор, который поэтому является самым электроотрицательным из всех галогенов.
По мере увеличения атомной массы галогенов электроотрицательный характер их ослабевает и, следовательно, уменьшается и окислительная способность галогена. Исходя из этого- самым сильным окислителем является фтор. Хлор и бром проявляют окислительные свойства в меньшей степени. Иод — наиболее слабый окислитель.
Будучи окислителями, галогены используются в медицине главным образом как дезинфицирующие вещества. Однако фтор и бром очень токсичны и в медицине не применяются.
Хлор применяется в качестве антисептика для обеззараживания воды. Иод — единственный из всех галогенов является- фармацевтическим препаратом и в виде спиртовых растворов- (5 и 10%) применяется в медицине.
Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение- дыхательных путей и воспаление слизистых оболочек.
Чаще галогены находят применение в медицине в виде соединений с другими элементами.
Из этих соединений значение для медицины $меют:
Соединения галогенов с водородом—.галогеноводородные кислоты (НС1, HBr, HI).
Соединения галогенов с кислородом общей формулы X2O, т. е. оксиды, которые с водой дают соответственно хлорноватистую, бромноватистую, йодноватистую кислоты.

Соединения со щелочными металлами — галогениды (NaCl, KCl, NaBr, KBr, NaI, KI).
Из соединений первой группы значение для медицины имеет хлористоводородная кислота (в фармации — соляная кислота). Это единственная минеральная кислота, которая постоянно присутствует в свободном виде в желудочном соке животных и человека.
Роль соляной кислоты желудочного сока состоит в том, что она превращает один из ферментов желудочного сока — пепсин в активную форму. И, кроме того, она выполняет еще одну важную функцию — уничтожает проникающих в желудок патогенных и гнилостных бактерий. Поэтому соляная кислота является фармацевтическим препаратом.
Государственная фармакопея приводит два препарата соля- юой кислоты.

Как та, так и другая кислота имеют одинаковые свойства и различаются лишь по количеству содержания хлороводорода и, соответственно, плотности.
Кислота хлористоводородная должна содержать хлороводорода в пределах 24,8—25,2%, плотность ее равна 1,125— 1,127 г/см3.
Кислота хлористоводородная разведенная содержит хлороводорода в пределах 8,2—8,4%, плотность ее равна 1,040— 1,041 г/см3.
Продажная концентрированная соляная кислота содержит 37% хлороводорода с плотностью 1,19 г/см3. Эта кислота «ды
мит»: хлороводород соединяется с аммиаком, который всегда есть в воздухе, образуя хлорид аммония, мельчайшие частички которого и создают впечатление дыма. Поэтому кислота и называется «дымящей».
Получается соляная кислота растворением в воде хлорово- дорода. Основным способом промышленного получения хлоро- водорода в настоящее время является синтез его из водорода и хлора, образующихся при электролизе раствора хлорида натрия.

Фармакопейные препараты соляной кислоты представляют собой бесцветную прозрачную жидкость, иногда с желтоватым оттенком, обусловленным примесью хлорида железа (III), которая может попасть из материала аппарата, где получают кислоту. Соляная кислота смешивается с водой и спиртом в любых соотношениях, имеет кислую реакцию на лакмус.
Подлинность подтверждается реакциями на анион Cl-:
а) с раствором нитрата серебра выпадает осадок хлорида серебра, растворимый в растворе аммиака.

б) при нагревании с диоксидом марганца выделяется свободный хлор (продукт окисления Cl- кислоты до молекулярного хлора — Cl2), который обнаруживается по запаху.
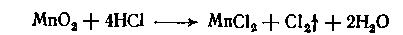
Для установления доброкачественности соляной кислоты проводят испытания на возможные примеси1:
Соли трехвалентного железа (FeCb) обнаруживают:
а) с раствором роданида калия по образованию окрашенного в красный цвет роданида железа (III);

Свободный хлор обнаруживается действием йодида калия в присутствии хлороформа, который окрашивается в фиолетовый цвет от выделившегося йода.

Концентрацию соляной кислоты можно определить:
методом нейтрализации — титрованием щелочью по метиловому оранжевому (фармакопейный метод)

по плотности — определенной концентрации кислоты соответствует определенное значение плотности. Зная эту величину по таблицам, приводимым в литературе, можно легко установить концентрацию кислоты соответствующей ее плотности. Например, плотности 1,19 г/см3 соответствует 36,5% хло- роводорода; плотности 1,125 г/см3 соответствует 25% хлорово- дорода.
В медицине находит применение кислота хлористоводородная разведенная. Применяют ее внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при недостаточной кислотности желудочного сока. Часто ее назначают совместно с препаратами железа, так как она способствует улучшению их всасывания.
Кислота хлористоводородная, предназначенная для медицинских целей, должна храниться в склянках с притертыми пробками при комнатной температуре. Нельзя хранить кислоту б очень теплых помещениях, так как в этом случае может выделяться газ (HCl), который нарушит укупорку склянки. Препарат относится к списку Б.
Не нашли, что искали? Воспользуйтесь поиском: