
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема №5. Хлористоводородная кислота.
6.2. Цель Ознакомление студентов со свойствами и с методологией оценки качества соляной кислоты.
Тезисы лекции
Кислота хлористоводородная
Acidum hydrochloricum
Кислота хлористоводородная разведенная
Acidum hydrochloricum dilutum
HCl М.м. 36,46
Получение:
Получается соляная кислота растворением в воде хлороводорода. Основным способом промышленного получения хлороводорода в настоящее время является синтез его из водорода и хлора, образующихся при электролизе раствора хлорида натрия
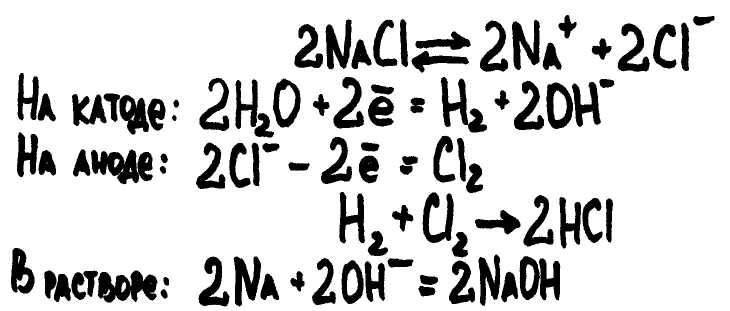
Описание:
фармакопейные препараты соляной кислоты представляют собой бесцветную прозрачную жидкость, иногда с желтоватым оттенком, обусловленным примесью хлорида железа (III), которая может попасть из материала аппарата, где получают кислоту. Соляная кислота смешивается с водой и спиртом в любых соотношениях, имеет кислую реакцию на лакмус.
Кислота хлористоводородная разведенная имеет состав: 1 часть HCl; 2 части H2O
Подлинность:
на анион Cl-:
а)с раствором нитрата серебра выпадает осадок хлорида серебра, растворимый в растворе аммиака
HCl + AgNO3 = HNO3 + AgCI
AgCl + NH4OH = [Ag(NH3)2]Cl + H2O
б) при нагревании с диоксидом марганца выделяется свободный хлор, который обнаруживается по запаху
MnO2+4HCl=MnCl2+Cl2 +2H2O
Чистота:
Для установления доброкачественности соляной кислоты проводят испытания на возможные примеси:
1. Соли трехвалентного железа (FeCl3) обнаруживают:
а) с раствором роданида калия по образованию окрашенного в красный цвет роданида железа (III)
FeCl3 + 3KSCN Fe(SCN)3 + 3KCl
Красное окрашивание
б) с раствором гексациано-феррат (II) калия (ферроцианида калия) по образованию «Берлинской лазури» синего цвета
4FeCl3 + 3K4[Fe(CN6)] Fe4[Fe(CN)6]3 + 12HCl
Берлинская лазурь (синий осадок)
2. Свободный хлор обнаруживается действием йодида калия в присутствии хлороформа, который окрашивается в фиолетовый цвет от выделившегося йода
Cl2 + 2KI I2 + 2KCl
3. Не допускается присутствие сернистой кислоты, SO42-, As, тяжелые Ме.
Количественное определение:
1) метод нейтрализации – титрование раствором щелочи по метиловому оранжевому
С%HCl = 24,8-25,2%; С%HClразв. =8,2-8,4%
HCl + NaOH NaCl + HOH
2) по плотности – определенной концентрации кислоты соответствует определенное значение плотности (ρ = 1,122-1,124)
Применение:
В медицине находит применение кислота хлористоводородная разведенная. Применяют ее внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при недостаточной кислотности желудочного сока. Часто ее назначают совместно с препаратами железа, так как она способствует улучшению их всасывания.
Хранение:
Кислота хлористоводородная, предназначенная для медицинских целей, должна храниться в склянках с притертыми пробками при комнатной температуре. Нельзя хранить кислоту в очень теплых помещениях, так как в этом случае может выделяться газ (HCl), который нарушит укупорку склянки.
Препарат относится к списку Б
ВРД – 2 мл (40 кап.)
ВСД – 6 мл (120 кап.)
Если в рецепте выписана HCl без указания концентрации, отпускается HCl разв. Если выписана HCl в иной концентрации без указания, что должна применяться разв. HCl, то при расчетах HCl разв. принимаем за 100%
6.4. Иллюстративный материал слайды с химическими и физическими свойствами соляной кислоты.
Литература
Основная литература:
1. Арзамасцев А.П. Фармацевтическая химия: учебное пособие, 3-е изд., испр. – М.: ГЭОТАР-Медиа, 2008. – 640 с.
2. Беликов В.Г. Фармацевтическая химия: учебное пособие, 2-е изд. – М.: МЕДпресс-информ, 2008. – 616 с.
3. Руководство к лабораторным занятиям по фармацевтической химии: Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. – М.: Медицина, 2001. – 384 с.
4. Государственная фармакопея Республики Казахстан: первое издание. – 1 том. – Астана: Изд. дом «Жибек жолы», 2008. – 592 с.
Дополнительная литература:
1. Анализ лекарственных смесей / Под ред. А.П. Арзамасцева, В.М. Печенникова, Г.М. Родионова и др. – М.: Компания Спутник+, 2000. – 275 с.
2. Арыстанова Т.А., Ордабаева С.К. Стандартизация лекарственных средств: учебное пособие. – Алматы, 2002. – 98 с.
3. Государственный реестр лекарственных средств. – М.: 2001. – 1277 с.
4. Бейсенбеков А.С., Шаншаров Г.Б., Галымов Е.Г., Бейсенбеков Н.А. Стандартизация лекарств: учебное пособие. – Алматы, 2008. – 167 с.
5. Государственная фармакопея СССР: Х издание. – М.: Медицина, 1968. – 1079 с.
6. Государственная фармакопея СССР: XI издание. – М.: Медицина, 1987. – Т.1. – 334 с.
7. От субстанции к лекарству: учебное пособие / Под ред. чл.-корр. НАН Украины В.П. Черных. – Харьков: изд-во НФаУ «Золотые страницы», 2005. – 1244 с.
Контрольные вопросы
1. Какими химическими реакциями устанавливается подлинность препаратов соляной кислоты.
2. Какие методы используют для количественного определения соляной кислоты
3. Какие испытания, кроме фармакопейных, могут быть использованы для идентификации катионов и анионов, входящих в состав молекул лекарственных препаратов данной группы?
Не нашли, что искали? Воспользуйтесь поиском: