
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гидролитическое расщепление
Общим свойством барбитуратов как циклических уреидов является их способность к гидролитическтму расщеплению в различных условиях. Так, в относительных мягких условиях (например, при длительном хранении в присутствии влаги и при повышенной температуре), возможен разрыв амидных связей в 1 – 2-м и 1-6 м положениях с образованием уровых кислот:

В жестких условиях (например, при сплавлении барбитурата с кристаллической щелочью) происходит более полная деструкция молекуля:

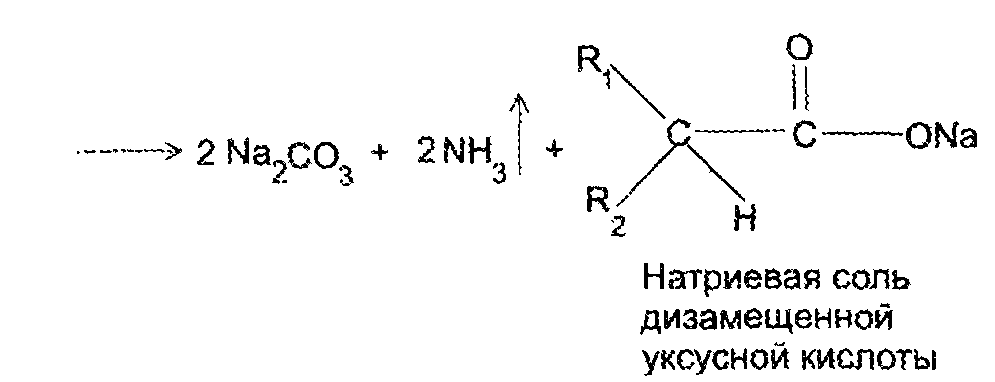
Конденсация с ароматическими альдегидами
Барбитураты способны к конденсации с альдегидами в присутствии концентрированной серной кислоты как водоотнимающего и окислительного реагента. При выборе соответствующего альдегида и условий можно получить специфически окрашенные продукты, позволяющие идентифицировать отдельные лекарственные вещества:

С формальдегидом фенобарбитал образует продукт розового цвета, а барбитал – желтого. В качестве реагента используют также различные ароматические альдегиды, например, n –диметиламинобензальдегид.
Часные реакции обусловлены особенностями химического строения отдельных лекарственных веществ группы барбитуратов, главным образом наличием заместителей в 1 м и 5 –м положениях. Например: фенобарбитал имеет в 5 –м положении фенильный радикал, по которому возможны SE –реакции, например нитрование с последующим восстановлением нитрогруппы, диазотированием и азосочетанием:


Контроль чистоты
Испытания на чистоту препаратов группы барбитуратов обусловлены их химическим свойствами и способами синтеза. Определение прозрачности проводят как для солевых, так и для кислотных форм барбитуратов. При испытании прозрачности кислотных формиспользуют их растворимость в карбонате натрия. Некоторые полупродукты синтеза и сопутствующие вещества не растворяются в карбонатах.
Изменение этого показателя для солевых форма обусловлено их возможным взаимодействием с оксидом углерода (IV) и влагой воздуха с образованием при этом нерастворимой кислотной формы:

У барбитала и фенобарбитала проверяют наличие моноалкилзамещенных производных барбитуровой кислоты (соответственно, этилбарбитуровой и фенилбарбитуровой). При наличии этих примесей с более выражеными кислотными свойствами, чем у лекарственных веществ группы барбитуратов, изменяются значения рН.
Возможную (допустимую до регламентированной ГФ) примесь свободной щелочи определяют титрованием в определенных условиях у препаратов солевой формы.
В гексанале и тиопентал - натрии определяют допустимую до определенного предела примесь метанола. Последний попадает в препарат при синтезе на стадии конденсации мочевины с дизамещенной малоновой кислотой, где в качестве катализатора используют метилат натрия. При определении примеси метанол окисляют пермангонатом калия до фомальдегида, который далее конденсируют с кислотой хромотроповой. Сравнивают интенсивность окраски образовавшегося продукта с эталонным раствором.
Методы количественного определения
Препараты лактамной (кислотной) формы количественно определяют методом кислотно – основного титрования. В качестве профильного растворителя используют диметилформамид. Титрант – 0,1 м раствор натрия гидроксида в смеси метанола и бензола; индикатор – тимоловый синий:

При количественном определении фенобарбитала лекарственное вещество растворяют в ацетоне или спирте, прибавляют необходимое количество воды и титруют 0,1 М раствором натрия гидроксида в присутствии индикатора тимолфталеина. Примечание данной методики показывает, что фенобарбитал обладает достаточно выраженными кислотными свойствами и может достоверно количественно определяться и в водной среде. Ацетон (или спирт) препятствует гидролизу образующейся при титровании соли.
Препараты солевой формы количественно определяют ацидиметрически. Навеску препарата растворяют в свежепрокипяченной воде (для удаления следов углекислоты) и титруют 0,1 М раствором хлороводородной кислоты в присутствии индикатора метилового оранжевого до розового окрашивания. При наличии в препарате свободной щелочи (определяемой при испытании на чистоту) из найденного процентного содержания вычитают процентное сождержание свободной щелочи, умноженное на соответствующий для каждого препарата коэффициент.
Другими методами количественного определения барбитуратов являются аргентометрия (в прямом и обратном вариантах) и гравиметрия. Гексенал можно определить количественно броиатометрически по фрагменту циклогексена.
Для количественного определения индивидуальных препаратов группы барбитуратов и особенно для их лекарственных форм применяют физико – химические методы анализа (ВЭЖХ, спектрофотометрия).
6.4. Иллюстративный материал слайды с уравнениями химических процессов по теме лекции, таблицы с показателями качества рассматриваемых препаратов.
Литература
Основная литература:
1. Арзамасцев А.П. Фармацевтическая химия: учебное пособие, 3-е изд., испр. – М.: ГЭОТАР-Медиа, 2008. – 640 с.
2. Беликов В.Г. Фармацевтическая химия: учебное пособие, 2-е изд. – М.: МЕДпресс-информ, 2008. – 616 с.
3. Руководство к лабораторным занятиям по фармацевтической химии: Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. – М.: Медицина, 2001. – 384 с.
4. Государственная фармакопея Республики Казахстан: первое издание. – 1 том. – Астана: Изд. дом «Жибек жолы», 2008. – 592 с.
Дополнительная литература:
1. Анализ лекарственных смесей / Под ред. А.П. Арзамасцева, В.М. Печенникова, Г.М. Родионова и др. – М.: Компания Спутник+, 2000. – 275 с.
2. Арыстанова Т.А., Ордабаева С.К. Стандартизация лекарственных средств: учебное пособие. – Алматы, 2002. – 98 с.
3. Государственный реестр лекарственных средств. – М.: 2001. – 1277 с.
4. Бейсенбеков А.С., Шаншаров Г.Б., Галымов Е.Г., Бейсенбеков Н.А. Стандартизация лекарств: учебное пособие. – Алматы, 2008. – 167 с.
5. Государственная фармакопея СССР: Х издание. – М.: Медицина, 1968. – 1079 с.
6. Государственная фармакопея СССР: XI издание. – М.: Медицина, 1987. – Т.1. – 334 с.
7. От субстанции к лекарству: учебное пособие / Под ред. чл.-корр. НАН Украины В.П. Черных. – Харьков: изд-во НФаУ «Золотые страницы», 2005. – 1244 с.
Контрольные вопросы
- Каково строение производных барбитуровой кислоты.
- Укажите препараты барбитуровой кислоты, их свойства, применение в медицине и методы анализа.
- Укажите известные вам препараты, производные лактамной формы барбитуровой кислоты, их свойства, хранение, применение в медицине и методы анализа.
- Назовите препараты, производные лактимной формы барбитуровой кислоты. Каковы их свойства, условия хранения и фармакологическое действие?
6.1. Тема. №20. Общая характеристика фенолов. Фенол, тимол, резорцин, тамоксифен.
6.2. Цель Сформировать у студентов знания по лекарственным препаратам, производным фенолов и хинонов. Дать полный обзор по методам анализа, хранению, применению препаратов в зависимости от строения и химических свойств.
Тезисы лекции
Не нашли, что искали? Воспользуйтесь поиском: