
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторна робота № 11 Приготування титрованого розчину комплексону ІІІ
Мета: Приготувати розчин комплексону ІІІ. Встановити нормальність трилону Б.
Обладнання та посуд:.
1.Бюретка, 50,0 мл;
2.Колба для титрування;
3. Мірна колба, 250 мл
4.Мірний циліндр, 25мл;
5. Піпетка на 25 мл;
6. Аміачна буферна суміш.
7.Сульфат магнію MgSO4;
8. Розчин трилону Б невідомої концентрації;
9. Індикатор - еріхром чорний Т.
Завдання:
1. Приготувати розчин комплексону ІІІ.
2. Встановити нормальність трилону Б.
Принцип методу. Двозаміщена натрієва сіль етилендіамінтетраоцтової кислоти не є вихідною речовиною (Na2H2C10H12O8N2 2H2O).

Спочатку готують розчин приблизної концентрації, а потім, титруванням робочим розчином MgSO4 або ZnSO4 визначають точну концентрацію. Використовують в якості індикатора еріхром чорний (ЕХЧ-Т), який відноситься до барвників групи 0,0¢-діоксіазонафталіну:

рК 6,3 рК 11,5

червоний синій жовто-оранжевий 
Індикатор застосовують при титруванні металів в інтервалі рН=7-11, у цьому інтервалі рН індикатор має синє забарвлення, а комплекси з металами Mg2+, Ca2+, Zn2+ та інші-червоне забарвлення.
Кінець титрування визначається за зміною забарвлення від червоного до синього кольору:
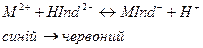

де Y4- -аніон етилендіамінтетраоцетової кислоти.
Розрахунки. Для приготування 1л 0,1 М розчину необхідно взяти наважку Na2H2C10H12O8N2∙2H2O
 г.
г.
Хід аналізу. Наважку солі MgSO4∙7H2O близько 3,1 г переносять у мірну колбу ємкістю 250,0 мл. Розчиняють сіль водою і наповнюють колбу дистильованою водою до риски. Відбирають піпеткою 25,0 мл розчину і переносять його у колбу для титрування, добавляють 5 мл аміачного буферного розчину і невелику кількість індикатора еріхром чорного Т. Суміш нагрівають до 600 С і титрують розчином комплексну ІІІ, концентрацію якого визначають, до зміни забарвлення розчину від черво-фіолетового до синього. Поблизу точки еквівалентності, розчин титранта добавляють по краплям і ретельно переміщують розчин. За результатами титрування обчислюють концентрацію розчину комплексону ІІІ.
C(Na2H2C10H12O8N2 2H2O)= 
Контрольні питання.
1. Суть метода визначення нормальності трилону Б.
2. Обчисліть масу наважки вихідної речовини.
3. Який механізм дії індикатора еріхром чорного Т?
4. Як обчислити нормальність трилону Б за результатами титрування?
Не нашли, что искали? Воспользуйтесь поиском: