
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторна робота № 10 Йодометричне визначення міді
Мета: Визначити масу міді.
Обладнання та посуд:.
1.Бюретка, 50,0 мл;
2.Колба для титрування;
3.Мірний циліндр, 25мл;
4. Титрований розчин Na2S2O3;
5.Сірчана кислота H2SO4 (1:4);
6.Калію йодид КІ;
7. 1% розчин крохмалю.
Завдання:
1. Обчислити масу міді.
В слабко кислому розчині йони міді Cu2+ окислюють йодистий калій з утворенням вільного йоду, який титрують стандартним розчином тіосульфату натрію

 а для йоду
а для йоду 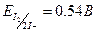 , тобто йодид є більш сильним окисником, ніж Сu2+. Здвиг рівноваги вправо пояснюється тим, що концентрація одновалентної міді в результаті утворення малорозчинного осаду різко зменшується, при цьому реальний потенціал системи зростає до +0,75 В.
, тобто йодид є більш сильним окисником, ніж Сu2+. Здвиг рівноваги вправо пояснюється тим, що концентрація одновалентної міді в результаті утворення малорозчинного осаду різко зменшується, при цьому реальний потенціал системи зростає до +0,75 В.

 моль/л
моль/л

При цьому виявлення міді проводять в слабко кислому середовищі, для припинення гідролізу.
Хід аналіза. До досліджуваного розчину додають 5 см3 сірчаної кислоти (1:4) та 1 г йодистого калію. Суміш стоїть 2-3 хвилини, а йод, що виділився титрують тіосульфатом натрію до появи жовтого забарвлення, а потім 1 см3 крохмалю (20 крапель), проводять титрування до зникнення синього забарвлення. Розраховують масу міді за формулою:

Контрольні питання.
1. Суть йодометричного метода визначення міді.
2. Для чого необхідно надлишок калію йодида?
3. З чим пов’язані помилки в йодометрії?
4. Як обчислити вміст міді за результатами титрування?
Комплексонометрія
Комплексонометрія ґрунтується на реакціях утворення комплексів. Титрування з використанням полідентантатних органічних реагентів називають комплексонометрією, а самі реагенти - комплексонами. В практиці використовують добре розчинну (108 г/л при 22оС) динатрієву сіль етилендіамінтетраоцтової кислоти Na2H2Y 2H2O (комплексон ІІІ), де Y4- - аніон поліамінокарбонової кислоти. Цей реагент широко відомий під торговою назвою – трилон Б.
Не нашли, что искали? Воспользуйтесь поиском: