
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
УРАВНЕНИЕ КЛАПЕЙРОНА-МЕНДЕЛЕЕВА.
Связь между давлением P, объемом V и температурой T дает уравнение состояния:
PV = (m/m)RT = nRT. (10.4.)
Молярная газовая постоянная R = 8,31 Дж/(моль.К).
Изопроцесс - это равновесный процесс, при котором один из параметров состояния не изменяется (постоянен).

|
| Рис.78. Семейство изотерм на плоскости (p, V).T3>T2> T1. |
Графическое изображение уравнения состояния называют диаграммой состояния. В случае изопроцессов диаграммы состояния изображаются двумерными (плоскими) кривыми и называются соответственно изотермами, изобарами и изохорами. Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим. При Т = То равенство
pV = pо Vо. (10.5.)

|
| Рис.79. Семейство изобар на плоскости (V, T). p3 > p2 > p1. |
Изобарический процесс если в ходе процесса давление и масса идеального газа не изменяются, то отношение объема газа к его абсолютной температуре есть величина постоянная:
V/T = const. (10.6.)

|
| Рис. 80. Семейство изохор на плоскости (p, T). V3 > V2 > V1. |
Изохорический процесс если в ходе процесса объем и масса идеального газа не изменяются, то отношение давления газа к его абсолютной температуре есть величина постоянная:
P/T = const. (10.7.)

|
| Рис.81. Зависимость давления газа от температуры при V = const. |
ГАЗОВЫЕ ЗАКОНЫ.
При одинаковых, давлении и температуре равные объемы различных газов содержат одинаковые числа молекул. Закон Авогадро означает, что давление газа при определенной температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы тяжелые или легкие. Количество вещества, содержащее число граммов, равное его молекулярному весу, называется грамм-молекулой или молем. М оли разных веществ содержат одно и то же число молекул. Поэтому часто оказывается удобным пользоваться молем как особой единицей, содержащей разное число граммов для различных веществ, но одинаковое число молекул. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных (частных) давлений входящих в нее газов
P = P1 + P2 +.... + Pn, (10.8.)
где P1, P2, Pn - парциальные давления это давления, которые оказывали бы газы смеси, если бы они одни занимали весь объем смеси при той же температуре. В одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро: N = 6,022.1023 моль. При одинаковых температурах и давлении все газы содержат в единице объема одинаковое число молекул (числом Лошмидта: 2,68.1025 м3.)
ПРИМЕР № 1.
В баллонах вместимостью V1 и V2 содержится газ. Давление в первом баллоне p1, во втором p2. Определить общее давление р и парциальные р1 и р2 после соединения баллонов, если температура газа осталась прежней.
Дано: Решение:
V1 p1(v1+v2)=p1v1
V2 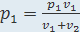
P1 p2(v1+v2)=p2v2
P2 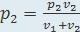
P-? 
P1-?
P2-?
Не нашли, что искали? Воспользуйтесь поиском: