
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Применение первого закона термодинамики к изохорным и изобарным процессам. Закон Гесса. Расчет тепловых эффектов
Во многих случаях химические реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии:
d QV = dU, QV = D U, (1.22)
а при постоянном давлении – изменению энтальпии:
d QP = dH, QP = D H. (1.23)
Энтальпия является важной термодинамической функцией и одновременно является функцией состояния системы. Она связана с внутренней энергией соотношением
H = U + PV.
Равенства (1.22) и (1.23) в применении к химическим реакциям составляют суть закона Гесса:
Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только видом и состоянием реагентов и продуктов реакции.
Другими словами, тепловой эффект химической реакции равен изменению функции состояния.
В термохимии, в отличие от других приложений термодинамики, теплота считается положительной, если она выделяется в окружающую среду, т.е. если D H <0 или D U < 0. Под тепловым эффектом реакции понимают значение D H (которое называют «энтальпией реакции») или D U реакции.
Если реакция протекает в жидком растворе или в твердой фазе, где изменение объема незначительно, то
DH =DU + PDV» DU.
Если же в реакции участвуют идеальные газы, то при постоянной температуре
D H = D U + P D V = D U + D nRT, (1.24)
где D n – изменение числа молей газов в реакции.
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций:
1. Стандартная энтальпия химической реакции равна разности энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
 (1.25)
(1.25)
Стандартной энтальпией (теплотой) образования вещества  называют энтальпию реакции образования одного моля этого вещества из простых веществ, находящихся в наиболее устойчивом состоянии при температуре 298 К.
называют энтальпию реакции образования одного моля этого вещества из простых веществ, находящихся в наиболее устойчивом состоянии при температуре 298 К.
2. Стандартная энтальпия химической реакции равна разности энтальпий сгорания исходных реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
 (1.26)
(1.26)
Стандартной энтальпией (теплотой) сгорания ( ) вещества называют энтальпию реакции полного окисления одного моля этого вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
) вещества называют энтальпию реакции полного окисления одного моля этого вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связи A – B называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние:
AB(г) ® A(г) + B(г).
Энергия связи всегда положительна (приложение 14).
Большинство термохимических данных в справочниках приведено для температуры 298 К.
Если в заданном температурном интервале происходит фазовое превращение одного или нескольких веществ, то удобно тепловой эффект рассчитывать на основании таблиц полных энтальпий или таблиц функций ( ):
):
 (1.27)
(1.27)
При наличии фазовых превращений в интервале температур от 298 К до Т удобно воспользоваться значениями ( ), приведенными в приложении 15 для температур от 298 до 1000 К.
), приведенными в приложении 15 для температур от 298 до 1000 К.
Пример 1.19.
Из опытных данных известно, что теплота сгорания H2 составляет  кДж/моль, а теплота сгорания CO в CO2 составляет
кДж/моль, а теплота сгорания CO в CO2 составляет  кДж/моль. Определить тепловой эффект реакции
кДж/моль. Определить тепловой эффект реакции
H2O + CO = H2+CO2+  .
.
Решение.
Имеем по условию задачи:
CO + 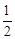 O2 = CO2 – 285,16 кДж/моль,
O2 = CO2 – 285,16 кДж/моль,
H2 + 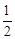 O2 = H2O – 241,84 кДж/моль,
O2 = H2O – 241,84 кДж/моль,
CO – H2 = CO2 – H2O – 43,32 кДж/моль.
В обычном написании уравнение химической реакции имеет вид
H2O + CO = H2 + CO2 – 43,32 кДж/моль.
Пример 1.20.
Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны –285,8 и –241,8 кДж/моль, соответственно. Рассчитайте энтальпию испарения воды при этой температуре.
Решение.
Энтальпии образования соответствуют следующим реакциям:
H2(г) + 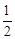 O2(г) = H2O(ж),
O2(г) = H2O(ж),  = – 285,8 кДж/моль;
= – 285,8 кДж/моль;
H2(г) + 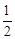 O2(г) = H2O(г),
O2(г) = H2O(г),  = – 241,8 кДж/моль.
= – 241,8 кДж/моль.
Вторую реакцию можно провести в две стадии: сначала сжечь водород с образованием жидкой воды по первой реакции, а затем испарить воду:
H2O(ж) = H2O(г),  =?
=?
Тогда, по закону Гесса,

откуда  = –241,8 – (–285,8) = 44,0 кДж/моль.
= –241,8 – (–285,8) = 44,0 кДж/моль.
Пример 1.21.
Найти теплоту образования AgCl(т) на основании следующих данных:
Ag2O(т) + 2HCl(ж) = 2AgCl(т) + H2O(г) +  ;
;
 = – 324,928∙106 Дж/кмоль;
= – 324,928∙106 Дж/кмоль;
2Ag(т) + 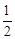 O2 = Ag2O(т) +
O2 = Ag2O(т) +  ;
;
 = – 30,590∙106 Дж/кмоль;
= – 30,590∙106 Дж/кмоль;
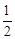 H2 +
H2 + 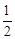 Cl2 = HCl(г) +
Cl2 = HCl(г) +  ;
;
 = –92,378∙106 Дж/кмоль;
= –92,378∙106 Дж/кмоль;
H2 + 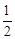 O2 = H2O(г) +
O2 = H2O(г) +  ;
;
 = – 286,043∙106 Дж/кмоль.
= – 286,043∙106 Дж/кмоль.
Решение.
Рекомендуем решать задачу следующим способом:
1) сначала записать термохимическое уравнение основной реакции, тепловой эффект которой необходимо определить;
2) записать уравнения, в которые входят исходные веще-
ства;
3) записать уравнения реакций, в которые входят реагенты, таким образом, чтобы конечные продукты находились с правой стороны, после чего произвести слева и справа сокращение формул одинаковых веществ;
4) последними записать уравнения тех реакций, которые позволяют исключить вещества, не входящие в данную реакцию.
Эти термохимические уравнения записываются таким образом, чтобы с обеих сторон оказались одни и те же вещества, что позволит их затем сократить:
Ag(т) + 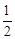 Cl2 = AgCl(т) +
Cl2 = AgCl(т) + 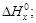
2Ag(т) + 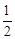 O2 = Ag2O(т) +
O2 = Ag2O(т) + 
2  H2 +
H2 + 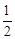 Cl2] = 2HCl(г) + 2
Cl2] = 2HCl(г) + 2 
Ag2O(т) + 2HCl = 2AgCl(т) + H2O(г) + 
H2O(г) = H2 + 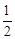 O2 –
O2 – 
2Ag(т) + Cl2 = 2AgCl(т) +  + 2
+ 2  +
+  –
– 
Следовательно,
2  о = 2
о = 2  p = –2
p = –2  p =
p =  0 + 2
0 + 2  0 +
0 +  0 –
0 –  0 =
0 =
= (–30,590 – 2∙92,378 – 324,928 + 286,043)∙ 106 =
–254,251∙106 Дж.
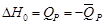 = –127,125∙106 кДж/моль.
= –127,125∙106 кДж/моль.
Пример 1.22.
Определить тепловой эффект реакции Al2O3(корунд) + + 3SO3 = Al2(SO4)3(т) + 
1) при температуре 298 К и давлении 1,0133∙105 Па;
2) при температуре 298 К, если реакция протекает в автоклаве при постоянном объеме.
Решение.
Для определения  воспользуемся следствием из закона Гесса. Тепловые эффекты образования исходных веществ и продуктов реакции из простых веществ находим в приложении 12:
воспользуемся следствием из закона Гесса. Тепловые эффекты образования исходных веществ и продуктов реакции из простых веществ находим в приложении 12:
2Al + 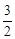 O2 = Al2O3(корунд) +
O2 = Al2O3(корунд) + 
S(ромб) + 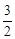 O2 = SO3(г) +
O2 = SO3(г) + 
2Al + 3S(ромб) + 6O2 = Al2(SO4)3(т) +  0,3
0,3
Энтальпия реакции  0,1
0,1 

кДж/моль –1675 –395,2 –3434
 = –3434∙106+1675∙106+3∙395,2∙106 =
= –3434∙106+1675∙106+3∙395,2∙106 =
= – 573,4∙106 Дж/кмоль.
По тепловому эффекту реакции определим тепловой эффект при постоянном объеме по уравнению (1.24):
Δ U 298 =  – ∆ nRT = –573,4∙106 – (–3) ∙8,314∙103∙298 =
– ∆ nRT = –573,4∙106 – (–3) ∙8,314∙103∙298 =
= –566,0∙106 Дж/кмоль.
Пример 1.23.
Определить теплоту образования метана, если теплота его сгорания  = –D H сгор = 890,964∙106 Дж/кмоль.
= –D H сгор = 890,964∙106 Дж/кмоль.
Теплоты сгорания водорода и углерода соответственно:
 –D H сгор = 286,043∙106 Дж/кмоль,
–D H сгор = 286,043∙106 Дж/кмоль,
 = –D H сгор = 353,796∙106 Дж/кмоль.
= –D H сгор = 353,796∙106 Дж/кмоль.
Решение.
Запишем уравнение реакции образования метана:
С(графит) + 2H2 = CH4 + 
Тепловой эффект реакции
 =
=  (
(  )сгор. исх. вещ–
)сгор. исх. вещ–  (
(  )сгор. прод. реакции =
)сгор. прод. реакции =
= (353,796+ 2∙268,043–890,964)∙106 = –1,082∙106 Дж/кмоль.
Пример 1.24.
Пользуясь справочными данными (приложение 13), рассчитать энтальпию реакции:
3Cu(т) + 8HNO3(aq) = 3Cu(NO3)2(aq) + 2NO(г) + 4H2O(ж)
при температуре 298 К.
Решение.
Сокращенное ионное уравнение реакции имеет вид
3Cu(т) + 8H+(aq) + 2NO3–(aq) = 3Cu2+(aq) + 2NO(г) + 4H2O(ж).
По закону Гесса, энтальпия реакции равна:
 = 4
= 4  (H2O(ж)) + 2
(H2O(ж)) + 2  (NO(г)) +
(NO(г)) +
+ 3  (Cu 2+(aq)) – 2
(Cu 2+(aq)) – 2  (NO3–(aq)),
(NO3–(aq)),
(энтальпии образования меди и иона H+ равны, по определению 0).
Подставляя значения энтальпий образования, находим
 = 4∙(–285,8) + 2∙90,25 + 3∙64,77 – 2∙(–205) = –358,4 кДж
= 4∙(–285,8) + 2∙90,25 + 3∙64,77 – 2∙(–205) = –358,4 кДж
(в расчете на 3 моль меди).
Пример 1.25.
Рассчитать энтальпию реакции 6С(г) + 6Н(г) = С6Н6(г)
а) по энтальпиям образования;
б) по энергиям связи, в предположении, что двойные связи в молекуле С6Н6 фиксированы.
Решение.
1. Энтальпии образования (в кДж/моль) находим в приложении 12:
 (С6Н6(г)) = 82,93;
(С6Н6(г)) = 82,93;  (С(г)) = 716,68;
(С(г)) = 716,68;
 (Н(г)) = 217,97.
(Н(г)) = 217,97.
Энтальпия реакции
 = 82,93 – 6∙716,68 – 6∙217,97 = –5525 кДж/моль.
= 82,93 – 6∙716,68 – 6∙217,97 = –5525 кДж/моль.
2. В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула С6Н6 содержит 6 связей С–Н, 3 связи С–С
и 3 связи С=С. Энергия связей Е (в кДж/моль)
Е (С–Н) = 412; Е (С–С) = 348; Е (С=С) = 612.
Энтальпия реакции
 = –(6∙412 + 3∙348 + 3∙612) = –5352 кДж/моль.
= –(6∙412 + 3∙348 + 3∙612) = –5352 кДж/моль.
Разница с точным результатом –5525 кДж/моль обусловлена тем, что в молекуле бензола нет одинарных связей С–С и двойных связей С=С, а есть 6 ароматических связей.
Пример 1.26.
На основе приведенных ниже термодинамических данных оценить энтальпию сгорания Δ Н сгор триэтиленамина (т):
N
 CH2 CH2 CH2
CH2 CH2 CH2
CH2 CH2 CH2
N
Продукты сгорания: СО2(г), Н2О(ж) и N2(г).
а) энергия связи Е С–С = 348,189 кДж/моль;
б) энергия связи Е Н–Н = 436,6 кДж/моль
в) энергия связи Е С–Н = 413,97 кДж/моль;
г) стандартная энтальпия образования  СО2(г) =
СО2(г) =
= –394,077 кДж/моль;
д) стандартная энтальпия образования  Н2О(ж) =
Н2О(ж) =
= –286,2499 кДж/моль;
е) стандартная энтальпия образования  СН3–СН3(г) =
СН3–СН3(г) =
= –84,788 кДж/моль;
ж) стандартная энтальпия сгорания  (СН3)3N(г) =
(СН3)3N(г) =
= –2445,7 кДж/моль;
з) энтальпия сублимация  (CH2CH2)3N = 62,012 кДж/моль.
(CH2CH2)3N = 62,012 кДж/моль.
Решение.
Комбинируя реакции, сопровождающие процесс сгорания триэтиламина, получаем
 = –6в + 3а + 3б –3д + 2ж + з = –4099,915 кДж/моль.
= –6в + 3а + 3б –3д + 2ж + з = –4099,915 кДж/моль.
Экспериментальное значение равно –4067,652 кДж/моль.
Пример 1.27.
Как изменится теплота сгорания акролеина при смене изобарического режима процесса на изохорический?
Решение.
Из уравнения (1.24) следует:

где  – число кмоль продуктов реакции минус число киломолей исходных веществ в газообразном состоянии. Значение
– число кмоль продуктов реакции минус число киломолей исходных веществ в газообразном состоянии. Значение  найдем из уравнения реакции горения 1 моль акролеина СН2= = СHCHO(г) + 3,5O2(г)
найдем из уравнения реакции горения 1 моль акролеина СН2= = СHCHO(г) + 3,5O2(г)  3CO2(г)+ 2H2O(ж):
3CO2(г)+ 2H2O(ж):
 = 3 – (1 + 3,5) = – 1,5.
= 3 – (1 + 3,5) = – 1,5.
Для процесса при температуре 298 К:
 –(–1,5)∙8,314∙298 = 3,72∙103 Дж/моль.
–(–1,5)∙8,314∙298 = 3,72∙103 Дж/моль.
Пример 1.28.
На какую величину при T = 298 К отличается тепловой эффект сгорания нафталина при постоянном давлении  от теплового эффекта при постоянном объеме
от теплового эффекта при постоянном объеме  согласно реакции
согласно реакции
С10Н8(т) + 12О2(г) = 10СО2(г) + 4Н2О(ж) +  ?
?
Решение.
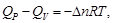
где  – число киломолей продуктов реакции минус число киломолей исходных веществ в газообразном состоянии:
– число киломолей продуктов реакции минус число киломолей исходных веществ в газообразном состоянии:
 = 10–12 = –2.
= 10–12 = –2.
 = –2∙8,315∙103∙298 = –4955,7∙103 Дж/кмоль.
= –2∙8,315∙103∙298 = –4955,7∙103 Дж/кмоль.
Пример 1.29.
Студент сделал следующий ошибочный вывод в лабораторном журнале по калориметрии в бомбе: « = =
= =  + P
+ P  . Поскольку в калориметрической бомбе процессы идут при постоянном объеме, то
. Поскольку в калориметрической бомбе процессы идут при постоянном объеме, то  = 0 и
= 0 и  =
=  » Объяснить, почему этот вывод неправильный.
» Объяснить, почему этот вывод неправильный.
Решение.
Ошибка состоит в применении уравнения, справедливого только при постоянном давлении, к процессу, который производится при постоянном объеме. Вообще H = PV + U и 
 При постоянном давлении
При постоянном давлении  и, следовательно,
и, следовательно, 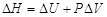 , а при постоянном объеме (например, процесс, проходящий в калориметрической бомбе)
, а при постоянном объеме (например, процесс, проходящий в калориметрической бомбе)  и
и  .
.
Пример 1.30.
Пользуясь формулой Коновалова, рассчитать удельную теплоту сгорания газообразного акролеина.
Решение.
Запишем уравнение реакции полного окисления (сгорания) 1 моль акролеина в кислороде:
СН2=СHCHO(г) + 3,5O2 (г)  3CO2 (г)+ 2H2O(ж).
3CO2 (г)+ 2H2O(ж).
Из записи следует, что для сгорания 1 моль акролеина требуется n = 3,5 моль кислорода и при этом образуется
m = 2 моль воды. Термическая характеристика межатомных связей молекулы акролеина определяется, исходя из того, что в ней есть одна двойная связь (X = 87,9 кДж/моль) и одна альдегидная группа (X = 75,3 кДж/моль). Суммируя термические характеристики X указанных связей в молекуле, получаем:
 X = 87,9 + 75,3 = 163,2 кДж/моль.
X = 87,9 + 75,3 = 163,2 кДж/моль.
Подставив соответствующие значения в формулу, находим:
 = – (204,2∙2×3,5 + 44,4∙2 + 163,2) =
= – (204,2∙2×3,5 + 44,4∙2 + 163,2) =
= –1681,4 кДж/моль.
Далее, разделив полученный результат на молярную массу акролеина
 0,056 кг/моль, получим ответ на вопрос задачи:
0,056 кг/моль, получим ответ на вопрос задачи:
 =
=  =
=  = –30,0 МДж/кг.
= –30,0 МДж/кг.
Пример 1.31.
Значения стандартных энтальпий растворения 1 моль натрия и оксида натрия в воде при стандартных условиях и температуре 298 Ксоответственно –183,79 и –237,94 кДж/моль. Вода в обоих случаях берется в большом избытке. Вычислить тепловой эффект ( ) образования оксида натрия из простых веществ при стандартных условиях и температуре 298 К.
) образования оксида натрия из простых веществ при стандартных условиях и температуре 298 К.
Решение.
Запишем уравнение реакции, тепловой эффект которой следует определить, и уравнения вспомогательных реакций:
2Na + 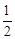 O2 = Na2O +
O2 = Na2O + 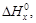 (1)
(1)
Na + Н2Оизб = NaОН(aq) + 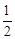 Н2 +
Н2 +  (2)
(2)
Na2O + Н2Оизб = 2NaОН(aq) +  (3)
(3)
Чтобы исключить из уравнений (2) и (3) NaОН(aq) в избытке воды, который не участвует в реакции (1), из уравнения (2), умноженного на 2, вычтем уравнение реакции (3):
2Na + 2Н2О – Na2O – Н2О = 2NaОН(aq) + Н2 +  –
–
– 2NaОН(aq) –  (4)
(4)
После преобразования уравнения (4) получим
2Na + Н2О = Na2O + Н2 +  –
– 
Чтобы исключить из уравнения (4) Н2О и Н2 и ввести О2, сложим уравнение (4) с уравнением реакции образования воды из простых веществ:
Н2 + 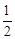 O2 = Н2О +
O2 = Н2О +  (5)
(5)
 = – 285,84 кДж/моль,
= – 285,84 кДж/моль,
 –
–
– (–237,94) + (–285,84) = = –415,48 кДж/моль.
Пример 1.32.
Определить тепловой эффект разбавления 30,8%-го водного раствора гидроксида натрия до концентрации 0,442 % при температуре 298 К.
Решение.
По справочным данным находим интегральные теплоты растворения (приложения 8–11). Так как концентрации выражены в молях Н2О на моль NaOH, то пересчитаем концентрации:
 моль NaOH растворено в
моль NaOH растворено в  моль Н2О,
моль Н2О,
1 моль NaOH растворено в Х 1 моль Н2О.
Х 1 =  моль Н2О на 1 моль NaOH.
моль Н2О на 1 моль NaOH.
Аналогично
 моль NaOH растворено в
моль NaOH растворено в 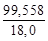 моль Н2О,
моль Н2О,
1 моль NaOH растворено в Х 2 моль Н2О.
Х 2 =  моль Н2О на 1 моль NaOH.
моль Н2О на 1 моль NaOH.
Интегральные теплоты растворения NaOH для начальной и конечной концентрации растворов:
число моль Н2О
на 1 моль NaOH 5 500
 кДж–37,76 –42,36.
кДж–37,76 –42,36.
 = –42,36 – (–37,76) = –4,6 кДж/моль.
= –42,36 – (–37,76) = –4,6 кДж/моль.
Разбавление раствора NaOH сопровождается выделением теплоты.
Пример 1.33.
Определить тепловой эффект реакции
2NaOH(т) + СО2(г) = Na2СO3(т) + Н2О(г)
при температуре 700 К и стандартном давлении.
Решение.
Выбор метода решения задачи по расчету теплового эффекта химической реакции, в которой участвуют конденсированные фазы, зависит от того, меняется ли фазовое состояние веществ в заданном интервале температур. Для выяснения фазового состояния необходимо по справочным данным определить температуры фазовых превращений:
| Вещество | Температура перекристаллизации α → β, К | Температура плавления, К | Температура кипения, К |
| α – NaOH | |||
| α – Na2СO3 | – |
Оба твердых вещества в интервале температур от 298 до 700 К меняют фазовое состояние. Расчет целесообразно провести по уравнению (1.27) (приложение 15):
| Вещество | α – NaOH | α – Na2СO3 | СО2(г) | Н2О(г) |
 кДж/моль кДж/моль
| –426,6 | –1129 | –292,51 | –241,84 |
 кДж/моль кДж/моль
| 42,748 | –57,612 | 17,782 | 14,226 |
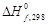 = –1129 – 241,84 + 2∙426,6 + 393,51 = –124,13 кДж,
= –1129 – 241,84 + 2∙426,6 + 393,51 = –124,13 кДж,
( ) = 57,612 + 14,226 – 2∙42,748 – 17,782 = = –31,440 кДж,
) = 57,612 + 14,226 – 2∙42,748 – 17,782 = = –31,440 кДж,
 =–124,13 – 31,440 = –155,570 кДж.
=–124,13 – 31,440 = –155,570 кДж.
Не нашли, что искали? Воспользуйтесь поиском: