
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Летучесть. Активность
Практическое использование термодинамических уравнений состояния связано с большими трудностями в вычислениях. Например, изменение энергии Гиббса при изотермическом процессе в соответствии с уравнением (2.51) должно быть равно  Но для отыскания этого интеграла необходимо подставить в подынтегральное выражение зависимость V от P. Для идеального газа эта задача решается с помощью уравнения Менделеева–Клапейрона. Для этого случая имеем
Но для отыскания этого интеграла необходимо подставить в подынтегральное выражение зависимость V от P. Для идеального газа эта задача решается с помощью уравнения Менделеева–Клапейрона. Для этого случая имеем
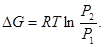 (2.69)
(2.69)
Совершенно иначе обстоит дело с реальным газом, для которого уравнение состояния гораздо сложнее, и под знаком интеграла будет стоять значительно более сложная функция.
В 1901 г. Льюис предложил для вычисления энергии Гиббса и химического потенциала реального газа использовать те же выражения, что и для вычисления соответствующих функций идеального газа. Отличие в том, что в них вместо давления подставляют переменную f, названную летучестью (по-английски fugacity). Летучесть (или, как ее иногда называют, фугитивность) можно определить как давление, которое должна была производить данная система, чтобы оказывать такое же действие, как и идеальная система. Это как бы исправленное давление. Летучесть характеризует отклонение реального газа от идеального состояния. С приближением реального газа к идеальному состоянию летучесть f по величине приближается к давлению P, так, что при всех давлениях обе величины становятся равными, т.е.
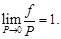 (2.70)
(2.70)
Из (2.70) видно, что летучесть и давление имеют одинаковые единицы измерения. Отношение летучести к давлению называют коэффициентом летучести g:
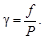 (2.71)
(2.71)
Коэффициенты летучести как функции давления и температуры для многих веществ приводятся в физико-химических справочниках. Летучесть была введена в термодинамическую практику в первую очередь для вычисления химических потенциалов газов. Но применение летучести этим не ограничивается. Летучесть можно использовать и тогда, когда чистое вещество находится в жидкой или твердой фазе. Вещество в состоянии насыщенного пара находится в равновесии с этим веществом в жидкой или твердой фазе. Таким образом, стандартные части химического потенциала вещества, находящегося в разных фазовых состояниях, могут быть отсчитаны от одного и того же стандартного состояния.
Наряду с летучестью для анализа поведения растворов и особенно для анализа фазовых равновесий в растворах используется еще одна величина, называемая активностью компонента раствора. Ее определение близко к определению летучести, и аналитически она формулируется так:
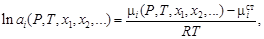 (2.72)
(2.72)
где ai – активность i -го компонента; 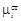 – химический потенциал этого компонента в состоянии, принимаемом за стандартное.
– химический потенциал этого компонента в состоянии, принимаемом за стандартное.
Для конденсированной системы, как правило, выбирают в качестве стандартного состояния состояние чистого вещества (в жидкой или твердой фазе), находящегося под давлением в одну атмосферу и при данной температуре.
При вычислении летучести стандартным является состояние идеализированного газа при давлении в 1 атм, в то время как при вычислении активности таковым является состояние чистой жидкости (чистого кристалла) при общем давлении в 1 атм.
Пример 2.9.
Выяснить возможность получения металлического кадмия из сульфида кадмия (II) восстановлением оксидом углерода (II) по реакции
2CdS(т) + 2CO(г) = CO2(г) + CS2(г) + 2α–Cd(т).
Решение.
В данном случае достаточно определить нормальное изменение энергии Гиббса, происходящее в результате рассматриваемой реакции.
Проще всего для этого воспользоваться значениями энергии Гиббса образования 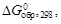 кДж/моль:
кДж/моль:
CO2(г)........................ –394,37
CS2(г)........................ 66,65
α–Cd(т)...................... 0,00
CdS(т)........................ –153,16
CO(г).......................... –137,15
Воспользовавшись следствием из закона Гесса, получаем
Δ G 0 = – 394,37 + 66,65 + 2∙0,00 – [2(– 153,16) +
+ (– 137,15)] = 252,88 кДж.
Таким образом, данная реакция при нормальных условиях самопроизвольно протекать не может.
Пример 2.10.
Установлено, что химические процессы, для которых изменение энергии Гиббса отрицательно, можно использовать в химической технологии. Определить температурные границы технологического использования реакции:
С2Н6(г) = С2Н4(г) + Н2(г).
Решение.
По данным задачи требуется определить выполнение условия
ΔG0 = (∆Н0 – Т∆S0) ≤ 0.
Для этого необходимо и достаточно, чтобы Т ≥ 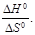 Допуская, что ∆ Н 0 и ∆ S 0 не зависят от температуры, заменим их на стандартные значения. Тогда решение задачи сведется к определению Т ≥
Допуская, что ∆ Н 0 и ∆ S 0 не зависят от температуры, заменим их на стандартные значения. Тогда решение задачи сведется к определению Т ≥  Значения ∆ Н 0 и ∆ S 0 определим, воспользовавшись следствиями из закона
Значения ∆ Н 0 и ∆ S 0 определим, воспользовавшись следствиями из закона
Гесса. Необходимые справочные данные берем из п риложения 12.
| Вещество | ∆ Н 0 f ,298, кДж/моль | S 0298, Дж/(моль·К) |
| С2Н6(г) | – 84,67 | 229,49 |
| С2Н4(г) | 52,30 | 219,45 |
| Н2(г) | 0,00 | 130,52 |
По этим данным для одного пробега реакции имеем:
∆ Н 0 = 52,30 + 0,00 – (– 34,67) = 136,97 кДж;
∆ S 0 = 219,45 + 130,52 – 229,49 = 120,48 Дж/К.
Далее, воспользовавшись ранее выведенным выражением, получаем
Т ≥  = 1137 К = 868 °С.
= 1137 К = 868 °С.
При температуре выше рассчитанной данная реакция может использоваться в химической технологии.
Пример 2.11.
При температуре 298 К смешали 2 моль кислорода
и 1 моль азота. Исходные давления газов и давление смеси ( ) одинаковы и равны 101 325 Па. Парциальные давления газов в смеси (
) одинаковы и равны 101 325 Па. Парциальные давления газов в смеси (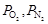 ) составляют 67 550 и 33 775 Па соответственно. Вычислить изменение энергии Гиббса, изменение энтропии и изменение энтальпии (Δ G 0, ∆ S 0 и ∆ Н 0) процесса смешения.
) составляют 67 550 и 33 775 Па соответственно. Вычислить изменение энергии Гиббса, изменение энтропии и изменение энтальпии (Δ G 0, ∆ S 0 и ∆ Н 0) процесса смешения.
Решение.
Так как процесс смешения газов необратим, заменяем его суммой обратимых процессов, протекающих в тех же условиях (граничных):

где 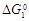 и
и  – изменения энергии Гиббса азота и кислорода за счет изменения давления от исходного давления (
– изменения энергии Гиббса азота и кислорода за счет изменения давления от исходного давления (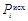 ) до парциального давления (
) до парциального давления (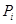 ) в процессе смешения. Согласно уравнению (2.69)
) в процессе смешения. Согласно уравнению (2.69)
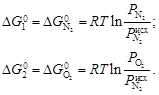
Поскольку исходные давления газов равны конечному давлению смеси, согласно уравнению Дальтона можно записать:
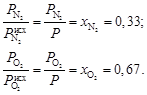
После подстановки чисел и вычислений получаем
ΔG 0 = RT ( ) = 8,314∙298 (ln 0,33 + 2 ln 0,67) = = –4800 Дж/моль.
) = 8,314∙298 (ln 0,33 + 2 ln 0,67) = = –4800 Дж/моль.
Вычисляем Δ S 0 с учетом уравнений (2.46):
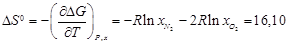 Дж/(моль·К)
Дж/(моль·К)
Для вычисления ∆ Н 0 используем уравнение (2.53):
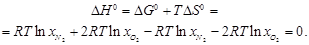
Пример 2.12.
Рассчитать изменение энергии Гиббса и изменение энергии Гельмгольца для 1 моль бензола в следующем изотермическом процессе:
С6Н6(ж) = С6Н6(г).
Начальное давление Р 1 = 101 325 Па, конечное давление
Р 2 = 91 200 Па. Нормальная температура кипения (Т н.т.к) = 353,3 К. Считать газообразный бензол идеальным газом.
Решение.
Представим себе, что процесс идет в две стадии:
1) при Р 1 = 101 325 Па, С6Н6(ж) = С6Н6(г);
2) С6Н6(г) (Р 1 = 101 325 Па) = С6Н6(г) (Р 2 = 91 200 Па).
Так как Δ G не зависит от пути процесса, то
ΔG = ΔG1 + ΔG2;
dG = VdP – SdT.
В первой стадии и темпер а тура, и давление не меняются, следовательно, Δ G 1 = 0.
Во второй стадии температура не изменяется, следовательно, dG 2 = VdP. Если принять, что пары бензола – идеальный газ, то, осуществив замену 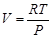 , получим
, получим
 .
.
Соответственно Δ F = Δ F 1 +Δ F 2;
dF = – PdV – SdT.
В первой стадии температура и давление постоянны. С учетом того, что объем пара много больше объема жидкости (V (г) >> V (ж)) получим:

Δ F 2 =  при Т = const
при Т = const 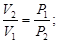
Δ F 2 = 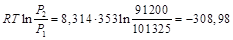 Дж/моль.
Дж/моль.
Δ F = – 2934,84 – 308,98 = – 3243,82 Дж/моль.
Пример 2.13.
Определить изменение энтальпии, изменение энтропии, изменение внутренней энергии, изменение энергии Гиббса, изменение энергии Гельмгольца при температуре 298 К и стандартном давлении (∆ Н 0, ∆ S 0, Δ U 0, Δ G 0, Δ F 0) для реакции
С2Н2(г) + 2Н2О(ж) = СН3СООН(ж) + Н2(г).
Решение.
Справочные данные необходимые для расчетов берем в приложении 12.
| Вещество |  кДж/моль
кДж/моль
|  Дж/(моль·К)
Дж/(моль·К)
| 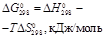
|
| С2Н2(г) | 226,75 | 200,80 | 209,25 |
| Н2О(ж) | – 285,84 | 69,96 | – 334,46 |
| СН3СООН(ж) | – 484,90 | 159,8 | – 576,64 |
| Н2(г) | 0,00 | 130,6 | 0,00 |
Тепловой эффект реакции, согласно закону Гесса,

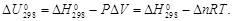
При расчете Δ n учитывают стехиометрические коэффициенты только газообразных веществ:
Δn = 
Следовательно, 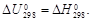
Энергия Гиббса для реакции
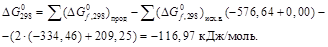
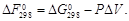
Для данной реакции P Δ V = 0. Следовательно, 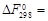
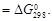
Изменение энтропии реакции:
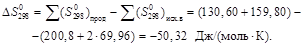
Пример 2.14.
Рассчитать изменение энергии Гиббса в реакции
CO + 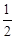 O2 = CO2 при температуре 500 К и парциальных давлениях 3 атм. Определить, будет ли эта реакция самопроизвольной при данных условиях. Газы считать идеальными.
O2 = CO2 при температуре 500 К и парциальных давлениях 3 атм. Определить, будет ли эта реакция самопроизвольной при данных условиях. Газы считать идеальными.
Решение.
Термодинамические данные при температуре 298 К и стандартном давлении 1 атм сведем в таблицу:
| Вещество |  кДж/моль
кДж/моль
| 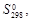 Дж/(моль·К)
Дж/(моль·К)
| CP,298, Дж/(моль·К) |
| CO O2 CO2 | –110,5 – 393,5 | 197,6 205,0 213,7 | 29,14 29,40 34,57 |
CO + 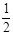 O2 = CO2 O2 = CO2
| – 283,0 | – 86,4 | – 9,27 |
Примем, что D CP = const. Изменения термодинамических функций в результате реакции рассчитаны как разность функций реагентов и продуктов D f = f (CO2) –
– f (CO) – ½ f (O2).
Стандартный тепловой эффект реакции при 500 К можно рассчитать по уравнению Кирхгофа в интегральной форме:
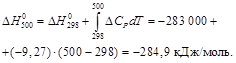
Стандартное изменение энтропии в реакции при 500 К можно рассчитать по формуле

Стандартное изменение энергии Гиббса при 500 К:

Для расчета изменения энергии Гиббса при парциальных давлениях 3 атм необходимо проинтегрировать формулу (2.52) и использовать условие идеальности газов
(D V = D nRT/P, D n – изменение числа молей газов в реакции):

Эта реакция может протекать самопроизвольно при данных условиях.
Пример 2.15.
2 моль гелия (идеальный газ, мольная теплоемкость CP = = 5/2 R) наревают от 100 до 200 °С при P = 1 атм. Вычислить изменение энергии Гиббса в этом процессе, если известно значение энтропии гелия: 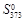 = 131,7 Дж/(моль·К). Можно ли этот процесс считать самопроизвольным?
= 131,7 Дж/(моль·К). Можно ли этот процесс считать самопроизвольным?
Решение.
Изменение энергии Гиббса при нагревании от 373 до 473 К можно найти, проинтегрировав частную производную по температуре (2.52):
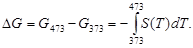
Зависимость энтропии от температуры при постоянном давлении определяется изобарной теплоемкостью:

В результате итегрирования этого выражения от 373 К до T получаем:
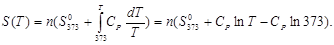
Подставляя это выражение в интеграл от энтропии, находим

Процесс нагревания не обязан быть самопроизвольным, так как уменьшение энергии Гиббса служит критерием самопроизвольного протекания процесса только при
T = const, P = const.
Пример 2.16.
Рассчитать D G 0 при T = 400 Кдля реакции
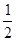 N2 +
N2 + 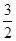 H2 = NH3,
H2 = NH3,
если 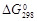 = –16,635 кДж/моль, недостающие данные взять в приложении 12.
= –16,635 кДж/моль, недостающие данные взять в приложении 12.
Решение.
Изменение энергии Гиббса реакции рассчитываем по уравнению
 .
.
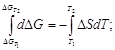
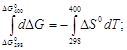
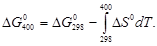
В зависимости от степени точности задачу можно решать следующими способами.
1-й способ. Допускаем, что энтропия реакции не зависит от температуры, т.е. 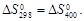 Из приложения 12 находим:
Из приложения 12 находим:
Вещество……………… N2 H2 NH3
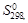 , Дж/(моль·К)…….. 191,5 130,6 192,5
, Дж/(моль·К)…….. 191,5 130,6 192,5
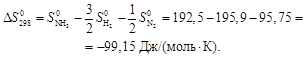
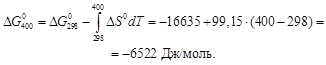
Полученный результат по данному способу является приближенным и дает большую ошибку в конечном результате.
2-й способ. Допускаем, что энтропия вещества зависит от температуры, т.е. D S = f (T); эта функция имеет вид
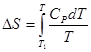 ;
;
энтропия реакции в зависимости от температуры рассчитывается по уравнению
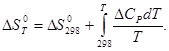
Предположим, что 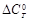 = const, тогда
= const, тогда
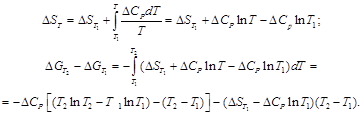
Из приложения 12 находим:
Вещество………………... N2 H2 NH3
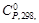 , Дж/(моль·К)…….. 29,10 28,83 35,65
, Дж/(моль·К)…….. 29,10 28,83 35,65
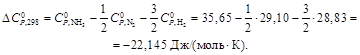

Предположим, что 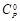 = f (T), тогда
= f (T), тогда

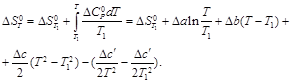
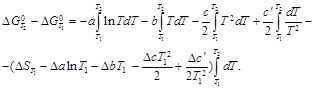
Из приложения 12 находим
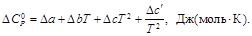
Вещество a b· 103 c c' ×10–5
N2 27,87 4,27 – –
H2 27,28 3,26 – 0,502
NH3 29,80 25,48 – –1,67
D a = –25,05 D b = 18,46×10–3 D c' = –2,42×105

Не нашли, что искали? Воспользуйтесь поиском: