
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задачи для самостоятельного решения 2 страница
ТЕСТ
1. Среди приведенных соотношений укажите неверное:
1) 1 бар = 100 кПа;
2) 1 атм = 760 мм рт. ст.;
3) 1 мм рт. ст. = 1 торр;
4) 1 Па = 1,013×105 атм.
2. При температуре 25 °С газ занимает объем 1 л. Объем газа (л) при температуре 100 °С равен:
1) 4,00; 2) 1,00; 3) 0,25; 4) 1,25.
3. Образец газа массой 0,554 г при температуре 20 °С и давлении 101,7 кПа занимает объем 0,51 л. Молекулярная масса газа (г/моль) равна:
1) 26; 2) 28; 3) 44; 4) 48.
4. Уравнение dS = d Q/T является:
1) математическим выражением второго закона термодинамики для обратимых процессов;
2) математическим выражением второго закона термодинамики для необратимых процессов;
3) математическим выражением первого закона термодинамики;
4) математическим выражением статистического определения энтропии.
5. При каких постоянных термодинамических параметрах изменение внутренней энергии D U может служить критерием направления самопроизвольного процесса? Какой знак D U в этих условиях указывает на самопроизвольный процесс?
1) при постоянных S и V; D U > 0;
2) при постоянных S и V; D U < 0;
3) при постоянных S и P; D U > 0;
4) при постоянных S и P; D U < 0.
6. Свойство внутренней энергии в общем случае:
1) функция, равная работе процесса;
2) экстенсивная функция;
3) интенсивная функция;
4) функция процесса.
7. Выражение для энтальпии индивидуального вещества:
1) U – TS;
2) U + PV – TS;
3) U + PV;
4) H – TS.
8. Условия, отличающие изолированную термодинамическую систему:
1) совокупность материальных объектов, занимающих неограниченную область пространства;
2) исключен обмен веществом и энергией с окружающей средой;
3) возможен обмен энергией с окружающей средой, но исключен обмен веществом;
4) возможен обмен веществом с окружающей средой, но исключен обмен энергией.
9. Термохимическое уравнение Кирхгофа выражает:
1) зависимость энтальпии вещества от температуры при постоянном давлении;
2) зависимость изменения энтальпии в процессе от температуры при постоянном давлении;
3) зависимость энтальпии вещества от давления при постоянной температуре;
4) зависимость изменения энтальпии в процессе от давления при постоянной температуре.
10. Критерий самопроизвольного протекания процессов в изолированных системах:
1) G > 0;2) V,T > 0;3) S > 0;4) H > 0.
11. Свойство энтропии в общем случае:
1) абсолютное значение не известно;
2) функция процесса;
3) функция, равная теплоте процесса;
4) мера неупорядоченности системы.
12. Теплота, которая требуется, чтобы повысить температуру 1 г вещества на 1 °С, называется:
1) удельной теплоемкостью;
2) молярной теплоемкостью;
3) теплотой образования;
4) энтальпией образования.
13. При стандартных условиях теплота сгорания водорода в кислороде равна 286,2 кДж/моль, а теплота сгорания водорода в озоне равна 333,9 кДж/моль. Теплота образования озона из кислорода при стандартных условиях равна:
1) –143,1 кДж/моль;
2) 47,7 кДж/моль;
3) –47,7 кДж/моль;
4) 0.
14. Уравнение Q = D U + W является:
1) математическим выражением второго закона термодинамики для обратимых процессов;
2) математическим выражением второго закона термодинамики для необратимых процессов;
3) математическим выражением первого закона термодинамики;
4) математическим выражением закона Кирхгофа.
15. Разность тепловых эффектов при постоянном давлении и постоянном объеме для реакции 2PbS(т) + + 3O2(г) = 2PbO(т) + 2SO2(г) при одной и той же температуре составляет:
1) RT;2) 2 RT;3) 3 RT; 4) 5 RT.
16. Реакция, для которой можно пренебречь разностью между изменением энтальпии и изменением внутренней энергии:
1) CaO(т) + CO2(г) = CaCO3(т)
2) Ca(OH)2(р–р) + CO2(г) = CaCO3(т) + H2O(ж)
3) Pb(т) + PbO2(т) = 2PbO(т)
4) 2AsH3(г) = 2As(т) + 3H2(г).
17. Выражение, справедливое для изохорной теплоемкости 1 моль идеального газа:
1) (¶ G/ ¶ T) p; 2) (¶ F/ ¶ T) V; 3) (dH/dT) P; 4) (dU/dT) V.
18. Работа системы при обратимом изобарном расширении n моль идеального газа от объема V 1 до объема V 2:
1) P (V 2 – V 1); 2) nR (ln V 2 – ln V 1); 3) – CV (T 2 – T 1); 4) 0.
19. Уравнение Кирхгофа имеет вид:
1) p 1 V 1 = p 2 V 2; 3) k = A ×e- E / RT ;
2) 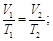 4)
4) 
20. Определите энтальпию реакции (кДж) S(к) + O2 (г) ®
® SO2 (г), если известны энтальпии реакций: 2S(к) + 3O2 (г) ® ® 2SO3 (г), D Н 0 = –792 кДж; SO2 (г) + ½ O2 (г) ® 2SO3 (г), D Н 0 = = –99 кДж:
1) – 297; 2) – 891; 3) – 495; 4) – 693.
21. При стандартной температуре для реакции 2NO2 (г) = = N2O4 (г) изменение энтальпии D Н 0 = –57 940 Дж/моль, энтропии D S = –164 Дж/моль×К. Значение энергии Гиббса (Дж/моль) равно:
1) 3232; 2) –13168; 3) –9068; 4) –3232.
22. Чему равна теплота плавления D Н пл (кДж/моль) при температуре тройной точки 692,7 К, если теплота возгонки D Н возг = 133,73 кДж/моль, теплота испарения D Н исп = = 126,825 кДж/моль:
1) 6,908; 2) –6,908; 3) 260,555; 4) –260,555.
23. Общее условие равновесия в системе переменного состава выражают с помощью уравнения:
1) å m ini = 0;
2) D G = – SdT + VdP;
3) D F = 0;
4) D F = D U – T D S.
24. Математическое выражение первого закона термодинамики для изолированной системы имеет вид:
1) D U = 0; 2) D H = 0; 3) D S = 0; 4) D H = D U + p D V.
25. Температурой начала реакции называют температуру, при которой;
1) D F = 0; 2) D F = D U; 3) W = 0; 4) Q = 0.
26. Энтропия индивидуального кристаллического вещества в виде идеального твердого тела при абсолютном нуле равна:
1) 1; 2) 100; 3) 0; 4) не возможно определить.
27. Идеальным газом называют:
1) легко сжимаемый газ;
2) газ, характеристики которого полностью описываются уравнением Вант–Гоффа;
3) газ, характеристики которого полностью описываются уравнением Менделеева-Клапейрона;
4) газ, нагретый свыше 1000 К.
28. Изменение энтропии положительно в случае:
1) CaCO3 (т) = CaO(т) + CO2 (г);
2) 4Al(т) +3O2 (г) = 2Al2O3 (т);
3) KOH(р-р) + CO2 (г) = KHCO3 (р-р);
4) 2NO2 (г) = N2O4 (ж).
29. Уравнение Кирхгофа характеризует зависимость:
1) теплового эффекта от температуры;
2) направления протекания реакции от температуры;
3) скорости реакции от температуры;
4) теплоемкости от температуры.
30. Величина, которую нужно подставить вместо парциального давления в выражение химического потенциала идеального газа, чтобы получить значение химического потенциала реального газа, называется
1) активностью;
2) фагитивностью;
3) коэффициентом активности;
 4) коэффициентом фугитивности.
4) коэффициентом фугитивности.
Список литературы
1. Стромберг А.Г. Физическая химия / А.Г. Стромберг, Д.П. Семченко. – М.: Высш. шк., 2003. – 527 с.
2. Жуховицкий А.А. Физическая химия / А.А. Жуховицкий, Л.А. Шварцман. – М.: Металлургия, 2001. – 668 с.
3. Вольхин В.В. Общая химия: в 3 кн. – Кн. 1. Основной курс / В.В. Вольхин; Перм. гос. техн. ун-т. – Пермь, 2006. – 464 с.
4. Физическая химия: в 2 кн. Кн. 1. Строение вещества. Термодинамика / К.С. Краснов [и др.]. – М.: Высш. шк., 2001. – 512 с.
5. Салем Р.Р. Физическая химия. Термодинамика / Р.Р. Салем. – М.: Физматлит, 2004. – 352 с.
6. Каретников Г.С. Сборник примеров и задач по физической химии / Г.С. Каретников, И.В. Кудряшов. – М.: Высш. шк., 1998. – 527 с.
7. Задачи по физической химии / В.В. Еремин [и др.]. М.: Экзамен, 2003. – 320 с.
8. Лабович Л. Задачи по физической химии с решениями / Л. Лабович, Д. Аренс. – М.: Мир, 1972. – 443 с.
9. Ахметов Б.В. Задачи и упражнения по физической и коллоидной химии / Б.В. Ахметов. – Л.: Химия, 1989. – 239 с.
10. Картушинская А.И. Сборник задач по химической термодинамике / А.И. Картушинская, Х.А. Лельчук, А.Г. Стромберг. – М.: Высш. шк., 1973. – 223 с.
11. Физическая химия: метод. указания и контр. задания для студ.-заочников химико-технолог. и технолог. спец. высш. учеб. заведений / под ред. С.Б. Авербуха, И.В. Кудряшов. – М.: Высш. шк., 1977. – 175 с.
12. Краткий справочник физико-химических величин / под ред. А.А. Равделя, А.М. Пономаревой. – СПб.: Специальная литература, 1998. – 232 с.
Приложения
Приложение 1
Единицы измерения физических величин
| Величина | Единица измерения в СИ | Связь с другими единицами |
| Масса | килограмм (кг) | 1 кг = 103 г = 106 мг |
| Длина | метр (м) | 1 м = 102 см = 109 нм |
| Площадь | кв. метр (м2) | 1 м2 = 104 см2 |
| Объем | куб. метр (м3) | 1 м3 = 106 см3 = 103 л |
| Давление | паскаль (Па) | 1 бар = 105 Па = 0,987 атм = 750 Торр 1 атм = 101325 Па = 760 Торр 1 Торр = 1 мм рт. ст. = 133,32 Па |
| Энергия | джоуль (Дж) | 1 Дж = 0,2390 кал = 10–3 кДж 1 кал = 4,184 Дж Спектроскопические единицы: 1 эВ = 8065,5 см–1 = 1,6022×10–19 Дж = 96485 Дж×моль–1 = 23060 кал×моль–1 1 см–1 = 1,2398×10–4 эВ = 1,9864×10–23 Дж =11,963 Дж×моль–1 = 2,8591 кал×моль–1 |
Приложение 2
Десятичные приставки к названиям единиц
| Приставка | Обозначение | Множитель | |
| русское | международное | ||
| тера гига мега кило гекто дека деци санти милли микро нано пико фемто атто | Т Г М к г да д с м мк н п ф а | T G M k h da d c m m n p f a | 1012 109 106 103 102 10–1 10–2 10–3 10–6 10–9 10–12 10–15 10–18 |
Приложение 3
Фундаментальные физические постоянные
| Величина | Обозначение | Значение | Размерность |
| Скорость света в вакууме | c | м × с–1 | |
| Атомная единица массы | 1 а.е.м. | 1,6605402×10–27 | кг |
| Заряд электрона | e | 1,60217733×10–19 | Кл |
| Постоянная Планка | h | 6,6260755×10–34 | Дж×с |
| Число Авогадро | N A | 6,0221367×1023 | моль–1 |
| Постоянная Больцмана | kB | 1,380658×10–23 | Дж×К–1 |
| Постоянная Фарадея | F | 96485,309 | Кл×моль–1 |
| Универсальная газовая постоянная | R | 0,0820578 | л×атм/(К×моль) |
| Молярный объем идеального газа (н.у.) | Vn | 8,314510 8,134510 8314,4255 22,414 | кПа×дм3/(К×моль) Дж/(К×моль) л×Па/(К×моль) л × моль–1 |
| Ускорение силы тяжести | g | 981,56 | м × с–1 |
Приложение 4
Постоянные Ван-дер-Ваальса
| Газ | a, л2×бар×моль–2 | b, см3×моль–1 | Газ | a, л2×бар×моль–2 | b, см3×моль–1 | |
| He Ne Ar Kr Xe H2 N2 O2 Cl2 CO CO2 | 0,03457 0,2135 1,363 2,349 4,250 0,2476 1,408 1,378 6,579 1,505 3,640 | 23,70 17,09 32,19 39,78 51,05 26,61 39,13 31,83 56,22 39,85 42,67 | NO NO2 H2O H2S NH3 SO2 CH4 C2H4 C2H6 C3H8 C6H6 | 1,358 5,354 5,536 4,490 4,225 6,803 2,283 4,530 5,562 8,779 18,24 | 27,89 44,24 30,49 42,87 37,07 56,36 42,78 5,714 63,80 84,45 115,40 |
Приложение 5
Критические константы и температуры Бойля
| Газ | T c, К | p c, бар | V c, мл × моль–1 | Z c | T B, К | T B/ T c |
| He Ne Ar Kr Xe H2 N2 O2 CO2 CH4 C2H4 | 5,21 44,44 150,72 209,4 289,75 33,3 126,1 154,4 304,2 190,7 282,4 | 2,27 26,9 48,0 54,3 58,0 13,0 34,0 50,5 73,8 46,0 50,4 | 57,76 41,74 75,25 92,24 118,8 65,0 89,5 73,4 94,0 99,0 129,0 | 0,305 0,307 0,292 0,291 0,290 0,306 0,292 0,292 0,274 0,287 0,277 | 22,64 122,1 411,5 575,0 768,0 110,0 327,2 405,9 714,8 510,0 624,0 | 4,35 2,75 2,73 2,75 2,65 3,30 2,60 2,63 2,35 2,67 2,21 |
Приложение 6
Вторые вириальные коэффициенты B, см3×моль–1
| T, К | 100 К | 273 К | 373 К | 600 К |
| Воздух Ar CH4 CO2 H2 He Kr N2 Ne O2 Xe | –167,3 –187,0 – – –2,0 11,4 – –160,0 –6,0 –197,5 – | –13,5 –21,7 –53,6 –142,0 13,7 12,0 –62,9 –10,5 10,4 –22,0 –153,7 | 3,4 –4,2 –21,2 –72,2 15,6 11,3 –28,7 6,2 12,3 –3,7 –81,7 | 19,0 11,9 8,1 –12,4 – 10,4 1,7 21,7 13,8 12,9 –19,6 |
Приложение 7
Интегральные теплоты растворения солей в воде при 25 °С
(при m = 0,00 даны значения D Hm, экстраполированные к бесконечному разбавлению)
| m,моли соли на 1кг H2O | D Hm, кДж/моль | |||||||
| LiCl | LiBr | NaCl | NaBr | NaI | KBr | KI | KCl | |
| 0,00 0,01 0,02 0,05 0,1 0,2 0,3 0,4 0,5 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 Насыщ. раствор m насыщ | –37,13 –36,97 –36,86 –36,71 –36,48 –36,34 –36,19 –36,07 –35,98 –35,65 –35,15 –34,52 –33,89 –33,18 –32,43 –31,63 –30,79 –29,92 –29,00 –19,35 19,90 | –49,02 –48,91 –48,87 –48,74 –48,62 –48,39 –48,28 –48,20 –48,12 –47,74 –47,11 –46,53 –46,02 –45,50 –44,85 –44,23 –43,51 –42,80 –41,97 –31,88 18,60 | 3,89 4,06 4,10 4,18 4,25 4,27 4,25 4,16 4,10 3,79 3,18 2,66 2,26 1,99 1,88 – – – – 1,95 6,15 | –0,63 –0,50 –0,42 –0,31 –0,29 –0,27 –0,29 –0,40 –0,44 –0,86 –1,65 –2,28 –2,78 –3,20 –3,47 –3,66 –3,70 –3,62 – –3,61 9,15 | –7,57 –7,41 –7,36 –7,24 –7,20 –7,15 –7,24 –7,32 –7,41 –7,82 –8,62 –9,37 –10,04 –10,54 –10,92 –11,13 –11,25 –11,25 –11,17 –10,59 12,33 | 20,04 20,17 20,25 20,29 20,33 20,29 20,25 20,15 20,04 19,54 18,68 17,99 17,36 16,82 – – – – – 16,49 5,70 | 20,50 20,67 20,71 20,73 20,71 20,67 20,59 20,42 20,29 19,73 18,62 17,66 16,82 16,09 15,47 14,92 14,46 – – 14,07 8,98 | 17,23 17,39 17,44 17,51 17,55 17,57 17,55 17,50 17,43 17,28 16,72 16,17 15,75 – – – – – – 15,45 4,82 |
| m,моли соли на 1кг H2O | D Hm, кДж/моль | |||||||
| NH4Cl | NH4NO3 | CaCl2 | K2SO4 | CuSO4 | MgSO4 | ZnSO4 | MnSO4 | |
| 0,00 0,01 0,02 0,05 0,1 0,2 0,3 0,4 0,5 | 14,73 14,85 14,94 15,02 15,10 15,19 15,23 15,27 15,27 | 25,77 25,77 25,79 25,82 25,75 25,56 25,38 25,21 25,06 | –82,93 –82,68 –82,38 –81,25 –80,88 –80,50 –80,25 –80,02 –79,83 | 23,71 24,48 24,58 24,75 24,78 24,58 24,27 23,95 23,58 | –73,14 –69,87 –69,33 –68,70 –68,07 –67,57 –67,32 –67,15 –67,03 | –91,63 –89,37 –89,04 –88,45 –87,91 –87,26 –86,92 –86,67 –86,48 | –83,26 –80,67 –80,29 –79,70 –79,16 –78,78 –78,58 –78,41 –78,28 | –64,39 –60,71 –60,12 –59,29 –58,70 –57,95 –57,53 –57,24 –57,07 |
| m,моли соли на 1кг H2O | D Hm, кДж/моль | |||||||
| NH4Cl | NH4NO3 | CaCl2 | K2SO4 | CuSO4 | MgSO4 | ZnSO4 | MnSO4 | |
| 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 Насыщ. раствор m насыщ | 15,31 15,27 15,23 15,19 15,15 15,10 15,02 – – – 15,02 7,35 | 24,31 23,05 21,97 21,17 20,46 19,92 19,41 18,95 18,54 18,16 – – | –79,04 –77,74 – – – – – – – – – – | – – – – – – – – – – 22,78 0,69 | –66,65 – – – – – – – – – – – | –85,77 –84,87 – – – – – – – – – – | –77,91 –77,03 –75,44 – – – – – – – – – | –56,65 –55,56 – – – – – – – – – – |
Приложение 8
Удельные теплоемкости водных растворов
| Вещество | Температура, °С | CP, Дж/(г×К), при концентрации m, моль/кг H2O | |||
| 2,22 | 1,11 | ,555 | 0,278 | ||
| CdSO4 | 2,91 | 3,40 | 3,74 | – | |
| CuSO4 | 18–23 | – | 3,52 | 3,80 | 3,98 |
| HCl | 3,68 | 3,90 | 4,04 | 4,10 | |
| HNO3 | 3,62 | 3,89 | 4,03 | – | |
| H2SO4 | 3,57 | 3,83 | 4,00 | 4,09 | |
| KCl | 3,46 | 3,78 | 3,97 | 4,06 | |
| KNO3 | 18–23 | 3,48 | 3,77 | 3,95 | 4,04 |
| KOH | 3,00 | 3,83 | 3,99 | 4,08 | |
| MgSO4 | 3,24 | 3,59 | 3,84 | 3,99 | |
| NH4CH3COO | 17,5 | 3,81 | 3,98 | 4,08 | – |
| NH4Cl | 3,67 | 3,92 | 4,04 | 4,11 | |
| NH4NO3 | 3,68 | 3,89 | 4,03 | – | |
| NaCH3COO | – | 3,93 | 4,04 | – | |
| NaCl | 3,68 | 3,90 | 4,03 | 4,09 | |
| NaNO3 | 3,61 | 3,83 | 3,98 | 4,08 | |
| NaOH | 3,80 | 3,94 | 4,05 | – |
Приложение 9
Интегральные теплоты растворения кислот и оснований в воде при 25 °С
| Число молей H2O на 1 моль кислоты или щелочи | m,моли кислоты или щелочи на 1кгH2O | –D H m, кДж/ моль | |||||||
| HCOOH | HCl | HNO3 | H2SO4 | H3PO4 | NH3 | NaOH | KOH | ||
 200
¥ 200
¥
| 55,51 27,75 18,50 13,88 11,10 9,25 6,94 5,55 3,70 2,78 1,85 1,39 1,11 0,740 0,555 0,278 0,111 0,0793 0,0555 0,0278 0,0111 0,0056 0,0028 0,0011 0,0000 | 0,83 0,87 0,79 0,71 0,67 0,62 0,58 0,56 0,55 0,55 0,56 0,57 0,60 0,65 0,66 – – – – – – – – – 0,71 | 26,23 48,82 56,85 61,20 64,05 65,89 68,23 69,49 70,99 71,78 72,59 73,02 73,28 73,65 73,85 74,20 74,52 74,61 74,68 74,82 74,93 74,99 75,04 75,08 75,14 | 13,11 20,08 24,30 26,98 28,73 29,84 31,12 31,84 32,46 32,67 32,76 32,75 32,74 32,74 32,75 32,80 32,90 32,94 32,98 33,05 33,13 33,19 – 33,27 33,34 | 28,07 41,92 48,99 54,06 58,03 60,75 64,60 67,03 70,17 71,50 72,68 73,09 73,35 73,68 73,97 74,94 76,73 77,57 78,58 80,88 84,43 87,07 89,62 92,34 96,19 | –4,52 –0,50 1,88 3,47 4,52 5,36 6,40 7,11 8,08 8,58 9,12 – 9,58 9,87 10,04 10,42 10,71 10,79 10,84 10,96 11,05 11,09 11,13 11,17 (13,4) | 29,54 32,05 32,76 33,26 33,60 – – 34,27 –34,43 34,48 34,48 34,52 – 34,56 34,64 – – – – – – – – 34,64 | – – 28,89 34,43 37,76 39,87 41,92 42,51 42,84 42,87 – – 42,53 – 42,34 42,30 42,36 – 42,47 42,55 42,66 42,72 – 42,80 42,87 | – – 41,80 45,77 48,24 49,87 51,76 52,66 53,62 53,95 – – 54,33 – 54,45 54,56 54,75 – 54,87 55,00 55,10 55,17 – 55,25 55,31 |

Приложение 10
Интегральные теплоты растворения солей,
образующих кристаллогидраты, при 25 °С
| Вещество | Число молей H2O на 1 моль соли | –D Hm, кДж / моль |
| BaCl2 | 11,18 | |
| BaCl2 ×H2O | –7,74 | |
| BaCl2 ×2H2O | –18,74 | |
| CuSO4 | 68,37 | |
| CuSO4 ×H2O | 40,42 | |
| CuSO4 ×3H2O | 12,68 | |
| CuSO4 ×5H2O | –10,50 | |
| LiCl | 36,53 | |
| LiCl ×H2O | 18,58 | |
| LiCl ×2H2O | 4,06 | |
| LiCl ×3H2O | –8,83 | |
| MgSO4 | 87,61 | |
| MgSO4 ×2H2O | 46,36 | |
| MgSO4 ×4H2O | 17,66 | |
| MgSO4 ×6H2O | 1,00 | |
| MgSO4 ×7H2O | –15,86 | |
| Na2CO3 | 23,43 | |
| Na2CO3 ×7H2O | –45,86 | |
| Na2CO3 ×10H2O | –69,04 | |
| Na2HPO4 | 25,94 | |
| Na2HPO4 ×2H2O | 0,17 | |
| Na2HPO4 ×7H2O | –47,95 | |
| Na2HPO4 ×12H2O | –96,06 | |
| ZnSO4 | 77,28 | |
| ZnSO4 ×H2O | 42,13 | |
| ZnSO4 ×6H2O | –4,31 | |
| ZnSO4 ×7H2O | –18,87 |
Приложение 11
Теплоты сгорания некоторых веществ
в стандартных условиях
Конечные продукты сгорания: CO2 (г), H2O (ж), SO2 (г), N2 (г). В соединениях, содержащих галогены, конечные продукты указаны в сносках.
| Формула вещества | Название |  кДж/моль
кДж/моль
|
| Углеводороды | ||
| CH4 (г) | Метан | 890,31 |
| C2H2 (г) | Ацетилен | 1299,63 |
| C2H4 (г) | Этилен | 1410,97 |
| C2H6 (г) | Этан | 1559,88 |
| C4H10 (г) | Бутан | 2877,13 |
| C4H10 (г) | Изобутан | 2868,76 |
| C5H10 (ж) | Циклопентан | 3290,73 |
| C5H10 (г) | Циклопентан | 3319,54 |
| C5H12 (ж) | Пентан | 3509,20 |
| C5H12 (г) | Пентан | 3536,15 |
| C6H6 (ж) | Бензол | 3267,58 |
| C6H6 (г) | Бензол | 3301,51 |
| C6H12 (ж) | Циклогексан | 3919,91 |
| C6H12 (г) | Циклогексан | 3953,00 |
| C6H14 (ж) | Гексан | 4163,05 |
| C6H14 (г) | Гексан | 4194,75 |
| C7H8 (ж) | Толуол | 3910,28 |
| C7H8 (г) | Толуол | 3947,94 |
| C8H10 (ж) | м-ксилол | 4551,81 |
| C8H10 (ж) | о-ксилол | 4552,80 |
| C8H10 (ж) | п-ксилол | 4552,80 |
| C8H18 (ж) | Октан | 5470,58 |
| C10H8 (т) | Нафталин | 5156,78 |
| C12H10 (т) | Дифенил | 6249,22 |
| C14H10 (т) | Антрацен | 7067,45 |
| C14H10 (г) | Фенантрен | 7049,87 |
| Кислородсодержащие соединения | ||
| CO (г) | Оксид углерода | 282,92 |
| CH2O (г) | Формальдегид | 561,07 |
| CH2O2 (ж) | Муравьиная кислота | 254,58 |
| CH4O (ж) | Метанол | 726,60 |
| C2H2O4 (т) | Щавелевая кислота | 251,88 |
| C2H4O (г) | Ацетальдегид | 1193,07 |
| C2H4O (г) | Этиленоксид | 1306,05 |
| C2H4O2 (ж) | Уксусная кислота | 874,58 |
| C2H6O (ж) | Этанол | 1370,68 |
| C3H6O (ж) | Диметилкетон (ацетон) | 1785,73 |
| C3H8O (ж) | Пропанол-1 | 2010,41 |
| C3H8O (ж) | Пропанол-2 | 1986,56 |
| C3H8O3 (ж) | Глицерин | 1661,05 |
| C4H8O2 (ж) | 1,4-Диоксан | 2316,56 |
| C4H8O2 (ж) | Этилацетат | 2246,39 |
| C4H10O (ж) | Бутанол | 2671,90 |
| C4H10O (ж) | Диэтиловый эфир | 2726,71 |
| C5H12O (ж) | Амиловый спирт | 3320,84 |
| C6H6O (т) | Фенол | 3063,52 |
| C6H6O2 (т) | Гидрохинон | 2860,60 |
| C6H12O6 (т) | a-Глюкоза | 2802,04 |
| C6H12O6 (т) | b-Глюкоза | 2808,04 |
| C7H6O2 (т) | Бензойная кислота | 3226,70 |
| C10H16O (т) | Камфора | 5924,84 |
| C12H22O11 (т) | Сахароза | 5646,73 |
| C18H36O2 (т) | Стеариновая кислота | 11274,6 |
| Галогенсодержащие соединения | ||
| CCl4 (ж) | Тетрахлорметан | 260,65* |
| CHCl3 (ж) | Трихлорметан (хлороформ) | 428,06** |
| CH3Cl (ж) | Хлорметан | 759,94*** |
| C6H5Cl (ж) | Хлорбензол | 3110,30*** |
| Серосодержащие соединения | ||
| COS (г) | Сероокись углерода | 553,12 |
| CS2 (ж) | Сероуглерод | 1075,29 |
| H2S (г) | Сероводород | 578,98 |
| Азотсодержащие соединения | ||
| CH3O2N (ж) | Нитрометан | 708,77 |
| CH4ON2 (т) | Карбамид (мочевина) | 632,20 |
| CH5N (г) | Метиламин | 1085,08 |
| C2H7N (г) | Диметиламин | 1768,59 |
| C2N2 (г) | Дициан | 1087,80 |
| C3H5O9N3 (ж) | Нитроглицерин | 1541,40 |
| C3H9N (г) | Триметиламин | 2442,92 |
| C5H5N (ж) | Пиридин | 2755,16 |
| C6H3O7N3 (т) | Пикриновая кислота | 2560,20 |
| C6H5O2N (ж) | Нитробензол | 3091,20 |
| C6H5O3N (т) | П-нитрофенол | 2884,00 |
| C6H7N (ж) | Анилин | 3396,20 |
* Продукты сгорания: CO2 и Cl2 (г).
Не нашли, что искали? Воспользуйтесь поиском: