
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Сильные и слабые электролиты
Изучение коллигативных свойств растворов электролитов показало, что в растворах присутствуют наряду с ионами и молекулы (диссоциация про исходит не полностью), т.е.
КА ↔ К+ +А-
Долю диссоциированных молекул характеризует степенью диссоциации (α). Степень диссоциации - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул N:α = n/N
Например: α = 20 %. Это значит, что из 100 молекул электролита 20 молекул распалось на ионы, КА <=> K+ +А- и в растворе присутствует 40 ионов, а также 80 не распавшихся молекул. Всего в растворе будет присутствовать 120 частиц.
Электролиты имеют различную степень диссоциации, которая зависит от концентрации электролита, от температуры. С уменьшением концентрации и повышением температуры степень диссоциации возрастает. Все электролиты по степени диссоциации делятся на сильные и слабые. Условно электролиты, для которых при концентрации растворов 0,01-0,1 н, степень диссоциации больше 50 % относят к сильным, а для которых меньше, чем 50 % - к слабым.
К сильным электролитам относятся:
СОЛИ, растворимые в воде,
ОСНОВАНИЯ элементов 1 и 2 групп главных подгрупп.
КИСЛОТЫ HCI, HBr, HJ,  ,
, 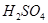 ,
, 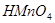 ,
, 
К слабым электролитам относятся:
СОЛИ, нерастворимые в воде,
ОСНОВАНИЯ НЕРАСТВОРИМЫЕ в воде, NH4ОН,
КИСЛОТЫ органические (СН3СООН), Н2S, Н2СО3, Н2SiО3, Н3ВО3.
Принято, что сильные электролиты при растворении в воде полностью диссоциируют на ионы; слабые ионы лишь частично.
Чтобы исключить влияние концентрации электролита для характеристики диссоциации используют константу диссоциации. Т.к. диссоциация является обратимым процессом, то согласно закона действующих масс;
Например: в водном растворе уксусной кислоты устанавливается равновесие
 |
СН3СООН Н+ + СН3СОО-
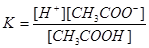
Константа равновесия в этом случае характеризует электролитическую диссоциацию и называется константой диссоциации /Кд/. Кд зависит от температуры и не зависит от концентрации раствора. По величине Кд можно судить о силе электролита.
Например: для одной и той же температуры Кд(NH4ОН) = 1,79*10-5; Кд(СН3СООН) = 1,75*10-5; Кд(НСN) = 4,79*10-10.
Самым слабым электролитом является НСN.
Не нашли, что искали? Воспользуйтесь поиском: