
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Растворяющие и избирательные свойства растворителей
Различный механизм межмолекулярного взаимодействия в экстракционных системах обусловливает различающиеся между собой растворяющие и избирательные способности у неполярных и полярных растворителей.
Классификация растворителей по признаку полярности их молекул не случайна. Именно полярность растворителей и, следовательно, соотношение составляющих Ван-дер-Ваальсовых сил, обусловливающих межмолекулярные взаимодействия в экстракционных системах, предопределяет растворяющие и избирательные свойства экстрагентов.
Основная составляющая Ван-дер-Ваальсовых сил в неполярных растворителях - дисперсионная. Дисперсионное взаимодействие -наиболее универсальный тип межмолекулярных взаимодействий, который проявляется вне зависимости от полярности молекул и потому преимущественно отражает растворяющие свойства растворителей. Электростатическая же составляющая (ориентационная + индукционная) Ван-дер-Ваальсовых сил предопределяет преимущественно избирательные свойства полярных растворителей. Следовательно, растворяющая и избирательная способности полярных растворителей будут обусловливаться соотношением электростатических и дисперсионных составляющих межмолекулярных взаимодействий.
Неполярные и слабополярные растворители характеризуются тем, что притяжения между молекулами растворителя и экстрагируемого вещества (компонента) происходят за счет дисперсионных сил. Поскольку дисперсионное взаимодействие зависит не от полярности, а главным образом от поляризуемости молекул, и оно оказывает преобладающее влияние по сравнению с другими составляющими межмолекулярного взаимодействия. Неполярные растворители являются более универсальными по растворяющей способности. но относительно менее селективными. Причем избирательность неполярных растворителей проявляется, в первую очередь, по молекулярной массе углеводородов и только затем по групповому химическому составу.
При обычных температурах неполярные и слабополярные растворители, например, низкомолекулярные алканы, бензол и толуол, смешиваются с жидкими углеводородами масляных фракций в лю-
| 40 60 |
| -40 -20 |
| Температура, "С Рис. 6.2. Зависимость растворимости парафинов с различной температурой плавления в сжиженном пропане от температуры |
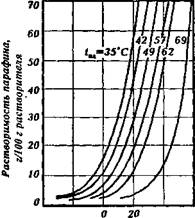 бых соотношениях по закономерностям идеальных растворов независимо от их химического строения. Избирательное же действие неполярных растворителей проявляется главным образом при экстракции (кристаллизацией) твердых углеводородов (высокомолекулярных парафинов и церезинов) при низких температурах, а также в отношении смол и асфальтенов при температурах, близких к критическим температурам растворителей (не путайте с КТР экстракции). У твердых углеводородов масляных фракций растворимость в неполярных растворителях ограниченная, и она зависит от молекулярной массы как углеводородов, так и растворителя, а также от температуры растворения (экстракции). С повышением молекулярной массы растворяемых твердых углеводородов (следовательно, и температуры плавления) она падает, а с повышением температуры экстракции растет, и при температуре плавления растворяемых углеводородов они смешиваются с растворителем неограниченно, подобно прочим жидким углеводородам (рис. 6.2). Растворимость твердых углеводородов в низкомолекулярных алканах зависит от молекулярной массы последних, причем эта зависимость экстремальна (рис. 6.3). Поэтому при растворении масляных фракций, содержащих углеводороды с высокой температурой плавления, образование истинных растворов возможно не при всяких температурах и соответственно не при всяких соотношениях с неполярным растворителем любой молекулярной массы. В тех случаях, когда температура растворения ниже температуры плавления твердых углеводородов последние независимо от их химического строения будут выделяться из растворителя в виде кристаллов и тем интенсивнее, чем выше их концентрация и молекулярная масса и чем ниже температура кипения растворителя.
бых соотношениях по закономерностям идеальных растворов независимо от их химического строения. Избирательное же действие неполярных растворителей проявляется главным образом при экстракции (кристаллизацией) твердых углеводородов (высокомолекулярных парафинов и церезинов) при низких температурах, а также в отношении смол и асфальтенов при температурах, близких к критическим температурам растворителей (не путайте с КТР экстракции). У твердых углеводородов масляных фракций растворимость в неполярных растворителях ограниченная, и она зависит от молекулярной массы как углеводородов, так и растворителя, а также от температуры растворения (экстракции). С повышением молекулярной массы растворяемых твердых углеводородов (следовательно, и температуры плавления) она падает, а с повышением температуры экстракции растет, и при температуре плавления растворяемых углеводородов они смешиваются с растворителем неограниченно, подобно прочим жидким углеводородам (рис. 6.2). Растворимость твердых углеводородов в низкомолекулярных алканах зависит от молекулярной массы последних, причем эта зависимость экстремальна (рис. 6.3). Поэтому при растворении масляных фракций, содержащих углеводороды с высокой температурой плавления, образование истинных растворов возможно не при всяких температурах и соответственно не при всяких соотношениях с неполярным растворителем любой молекулярной массы. В тех случаях, когда температура растворения ниже температуры плавления твердых углеводородов последние независимо от их химического строения будут выделяться из растворителя в виде кристаллов и тем интенсивнее, чем выше их концентрация и молекулярная масса и чем ниже температура кипения растворителя.
|
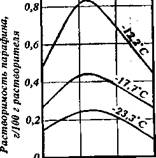
| 40 80 120 160 |
| Молекулярная масса растворителя Рис. 6.3. Изменение растворимости парафинов (tnjI=50°C) в углеводородных растворителях различной молекулярной массы |
Следовательно, неполярные растворители при низких температурах растворяют углеводороды масляных фракций избирательно в зависимости от их температуры плавления. Эта закономерность углеводородов обусловливает возможность использования неполярных растворителей для целей депа-рафинизации кристаллизацией масляных рафинатов, выделения нафталина, разделения ксилолов и т.д. Следует отметить, что для этих целей могут применяться и некоторые полярные растворители, например, ацетон, метилэтилкетон или их смеси с неполярными растворителями, в среде которых проявляется аналогичная избирательность растворимости твердых углеводородов.
Низкая растворимость твердых углеводородов объясняется тем, что они, имея трехмерную упорядоченную структуру, обладают высоким уровнем энергии связи между молекулами. Введение в систему растворителя, хотя и ослабляет межмолекулярное взаимодействие, но оно, особенно при низких температурах, может оказаться недостаточным для полного разрушения кристаллической структуры и перевода твердых углеводородов в раствор.
Установлено, что при экстракции неполярными экстрагентами при температурах вблизи критического состояния растворителей также проявляется избирательная растворимость высокомолекулярных углеводородов масляных фракций. Обусловливается это тем, что с приближением температуры экстракции к критической происходит резкое снижение плотности растворителя и соответственное ослабление прочности связей между молекулами растворителя и растворенных в нем углеводородов. В то же время силы дисперсионного взаимодействия между молекулами самих углеводородов при этом практически не изменяются. В результате при определенных температурах внутримолекулярные силы углеводородов могут превысить
| 100 |
| ^2 | v; | |||
| ^3 | ||||
| т — | ч-*^^ |
| S 80 а я-« 1.60 |
| о к о I |
| <3 е. а к в * 8- о |
| ,40 |
| 5 20 |
| о |
| 40 50 60 70 80 90 Температура, °С Рис. 6.4. Зависимость растворимости смол и углеводородов различного строения в пропане от температуры: 1 - нафтено-па-рафиновые (п"=1,49); 2 - легкие ароматические (п"=1,49-1,53); 3-^гяжелые ароматические (п"> 1,53); 4 - смолы |
межмолекулярные силы взаимодействия между растворителем и углеводородами и последние выделяются в виде дисперсной фазы. При этом, поскольку энергия дисперсионного взаимодействия является функцией от молекулярной массы молекулы, в первую очередь из раствора выделяются наиболее высокомолекулярные смолисто-ас-фальтеновые соединения, затем по мере повышения температуры - углеводороды с меньшей молекулярной массой. При температурах, превышающих критическую, из раствора выделяются все растворенные в нем соединения независимо от молекулярной массы и химической структуры углеводородов (рис.6.4). Наблюдающаяся при этом избирательность разделения по химическому строению молекул является следствием различия сил межмолекулярного взаимодействия углеводородов сырья. Так, силы взаимного притяжения молекул парафиновых и нафтеновых углеводородов значительно слабее, чем ароматических и смол. Поэтому при одинаковых молекулярных массах более легко переходят в слой неполярного растворителя парафино- нафтеновые углеводороды, чем ароматические и смолы или асфальтены, тем самым достигается определенная избирательность разделения и по химическому строению молекул.
Из табл. 6.1 видно, что критическая температура у алканов повышается при переходе от пропана к бутану и далее пентану. У метана и этана критические температуры значительно ниже, однако у них слишком низкие температуры кипения, что обусловливает необходимость проведения жидкофазного процесса экстракции при высоких давлениях. В этой связи для целой деасфальтизации нефтяных остатков в качестве растворителя преобладающее применение получил сжиженный пропан.
Таким образом, неполярные растворители при температурах вблизи критической избирательно растворяют высокомолекулярные углеводороды масляных фракций и разделяют их прежде всего по молекулярной их массе, только затем по их химическому строению.
Следует отметить, что в процессах деасфальтизации пропан выступает не только как избирательный растворитель, но и одновременно как коагулятор смолисто-асфальтеновых веществ. Известно, что асфальтены в нефтяных остатках присутствуют только в коллоидном состоянии. При этом дисперсионной фазой являются асфальтены, а дисперсионной средой - масла, в т.ч. полициклические ароматические углеводороды и смолы сырья. В разбавленных растворах, в которых растворитель, как, например пропан, не обладает способностью растворять асфальтены, имеет место коагуляция последних. С точки зрения коагулирующей способности, алканы с молекулярной массой меньше, чем у пропана (этан, метан), превосходят пропан. Однако они требуют, как было указано выше, проведения процесса деасфальтизации при чрезмерно высоких давлениях.
Растворяющие и избирательные свойства полярных растворителей обусловливаются, как указывалось ранее, энергией и соотношением дисперсионных и электростатических составляющих Ван-дер-Ваальсовых сил.
Как известно, полярность у органических веществ обусловливается наличием в их молекулах функциональных групп, таких, как алкильных (-С„Н2п+1), гидроксильных (-ОН), карбонильных (>С=0), карбоксильных (-СООН), эфирных (-О-), аминных (-NH2), иминных (>NH), нитрильных (>N-), нитрогрупп (-NOz) и др.
На растворяющую способность полярных растворителей существенное влияние оказывают тип, количество и место расположения функциональных групп, способность их образовывать водородные связи, а также молекулярная масса и химическая структура (ациклическое или циклическое строение, изомерия, симметричность и др.) основной (ядерной) части* их молекул. Так, бензол, имеющий симметричную молекулярную структуру, не обладает дипольным моментом, в то время как толуол и ксилолы, содержащие метильные группы, относятся к типу полярных (слабополярных) растворителей.
* В химической литературе часть молекул за исключением функциональных групп ошибочно называют радикалом.
Таблица 6.2
Влияние химической структуры молекул полярных растворителей на их растворяющую способность
| Растворитель | Формула | Дипольный момент, D | КТР,°С | Выход растворенного компонента, % масс. |
| Анилин Фенол Нитробензол Фурфурол | -./ОН | 1,51 1,70 4,23 3,57 | 96,2 79,4 66,6 42,0 | |
| Диметилкетон Диэтилкетон Метилбутилкетон | (СН,)2СО (С2Н5)2СО СН3(СО)С4Н, | 2,85 2,72 2,16 | 54,4 -42,0 -53,0 | |
| Этанол н- Бутанол н-Гексанол н-Октанол | С2Н5ОН С4Н,ОН с,н„он с,н17он | 0 71 89 100 |
В молекулах полярных растворителей, таких как фенол, анилин и нитробензол, имеются соответственно гидроксиль ная, аминная и нит-
рогруппы.
По результатам многочисленных исследований установлены следующие основные закономерности по влиянию химической структуры молекул полярных растворителей на их растворяющую способность (PC) (табл. 6.2):
1) у растворителей с моноциклической молекулярной структурой с одной функциональной группой PC растет симбатно их диполь-ным моментам;
2) у растворителей с ациклической структурой с одной и той же функциональной группой PC повышается с увеличением длины ал-кильной цепи независимо от значений их дипольных моментов (за счет увеличения доли дисперсионных сил);
3) наличие в молекуле растворителя второй и более функциональных групп снижает его PC (как у фурфурола и N-метилпир-ролидона);
4) наличие в молекуле полярного растворителя функциональных групп, способных образовывать водородные связи, всегда приводит к снижению их PC.
На избирательную способность полярных растворителей также влияют величина дипольного момента и особенности молекулярной их структуры. Исследования показали, что у органических соединений одного и того же класса, различающихся только функциональной группой, избирательная способность увеличивается с ростом дипольного момента их молекул. Такая закономерность характерна как для ароматических, так и для алифатических растворителей. Функциональные группы по их влиянию на избирательную способность растворителя располагаются в следующей последовательности:
N02 > CN > СО > СООН > ОН > NH2.
Введение в состав алифатического растворителя второй функциональной группы (в отличие от растворяющей способности) повышает избирательность, причем группа, не способная образовывать водородную связь - более эффективно, по сравнению с группой с водородной связью (например, -ОН и -NH2 группы).
По степени влияния химической структуры основной цепи молекул на избирательную способность растворителей с одинаковой функциональной группой установлена следующая последовательность: тиофеновое кольцо > бензольное кольцо > фурановое кольцо > алифатическая цепь.
Растворимость углеводородных компонентов масляных фракций в полярных растворителях зависит как от растворяющей способности последних, так и от химического состава, прежде всего способности молекул сырья поляризоваться под действием электрического поля молекул растворителя. При идентичных условиях в полярных растворителях лучше всех растворяются полярные компоненты сырья*, то есть смолы и другие неуглеводородные компоненты; в этом случае наряду с ориентационными проявляются и дисперсионные силы межмолекулярного взаимодействия. Углеводородные компо-
*На этом основании раньше было предложено правило: растворитель растворяет себе подобное.
ненты сырья являются преимущественно неполярными или слабополярными соединениями и растворяются в полярных растворителях в результате взаимодействия постоянных диполей молекул растворителя с индуцированными диполями молекул углеводородов. Наибольшим значением средней молекулярной поляризации характеризуются ароматические углеводороды, наименьшим - парафиновые, а нафтеновые занимают промежуточное положение. Вследствие этого ароматические углеводороды имеют самые низкие значения КТР в полярных растворителях, а парафиновые - самые высокие. По растворимости углеводородных компонентов масляных фракций в полярных растворителях установлены следующие закономерности:
1) самую высокую растворимость имеют ароматические углеводороды;
2) с ростом числа колец в молекуле углеводорода сырья растворимость резко возрастает;
3) с увеличением длины алкильных цепей растворимость снижается;
4) при одинаковом числе атомов углерода в кольцах нафтеновых и ароматических углеводородов растворимость последних значительно выше;
5) самую низкую растворимость имеют нормальные парафиновые углеводороды;
6) растворимость твердых углеводородов в полярных (как и в неполярных) растворителях ниже, чем жидких;
7) растворимость всех компонентов масляных фракций в полярных растворителях растет с повышением температуры.
Для получения высокоиндексных масел с достаточно высоким выходом большое значение имеет оптимальное сочетание растворяющей способности и избирательности полярных растворителей. В ряде случаев возникает необходимость улучшить одно из этих свойств без ухудшения другого. С этой целью к основному растворителю добавляют небольшое количество другого, улучшающего одно из свойств первого. Для снижения растворяющей способности основного растворителя в качестве антирастворителя в промышленных условиях часто применяют воду. Однако вода обладает тем недостатком, что из-за высокой теплоты испарения требует больших затрат энергии при регенерации растворителя. Кроме того, добавка воды не всегда приводит к увеличению избирательности смешанного растворителя.
В промышленной практике, например, при депарафинизации масел, для повышения растворяющей способности основного растворителя (кетонов) широко используют бензол и толуол. Однако при этом одновременно снижается избирательность смешанного растворителя.
Таким образом, использование смешанных растворителей в экстракционных процессах позволяет регулировать их растворяющую и избирательную способности.
Выбор растворителей для промышленных экстракционных процессов очистки масляного сырья значительно облегчается тем обстоятельством, что удаление нежелательных компонентов масел осуществляют путем последовательной (ступенчатой) экстракции: вначале проводят деасфальтизацию и обессмоливание гудронов (I ступень), затем деароматизацию деасфальтизата и масляных дистиллятов (II ступень) и далее депарафинизацию рафинатов (III ступень). Следовательно, целевым назначением каждой ступени экстракции становится извлечение только одного компонента, а не сразу всех нежелательных компонентов масляного сырья, для чего, естественно, значительно легче подобрать оптимальный растворитель.
Не нашли, что искали? Воспользуйтесь поиском: