
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Приготування розчину лугу 2 страница
В багатьох випадках розчинність твердої речовини можна підвищити, нагріваючи розчин. Але розчинність деяких солей або знижується з підвищенням температури або підвищується тільки до певної температури, потім падає.
Кожній температурі відповідає певна розчинність речовини. Якщо охолодити насичений розчин речовини, розчинність якого з температурою підвищується, то розчинена речовина випадає в осад в такій кількості, що розчин залишається насиченим при тій температурі, до якої він охолоджений. Але іноді при повільному охолоджуванні розчинена речовина не виділяється. Тоді говорять, що розчин пересичений. Це дуже нестійкий стан розчину, достатньо порошинці потрапити в розчин, щоб надлишок солі випав в осад.
Розчин кипить при більш високій температурі, а замерзає при більш низькій температурі, ніж розчинник.
Швидкість розчинення твердої речовини залежить від розміру його частинок, тому перед розчиненням твердої речовини його необхідно подрібнити в ступці і для розчинення брати наважку подрібненої речовини. Гігроскопічні речовини в подрібненому вигляді дуже легко поглинають вологу з повітря внаслідок великого збільшення поверхні. Тому їх розчиняють, не подрібнюючи, тільки швидко розбивши великі шматки.
При неправильному введенні речовини в колбу вона може розбитися, тому колбу нахиляють під кутом до 45° і опускають тверду речовину так, щоб вона скачувалося по горлу і стінці колби. Зручно налити частину необхідної кількості розчинника і додавати тверду речовину, іноді струшуючи колбу. Потім вводять частину розчинника, що залишився.
Смолисті речовини корисно розрізати на невеликі шматки і поступово водити в розчинник.
Розчинність газів залежить від температури води і зовнішнього тиску. Чим вище парціальний тиск газу, тим більше він розчиняється у воді. Чим вище температура води, тим менше розчинність газів. Тому воду для видалення розчинених газів кип'ятять.
При взаємному розчиненні рідин спостерігається три випадки: 1) рідини практично не розчиняються одна в одній; 2) рідини змішуються в певних кількостях; 3) рідини необмежено розчиняються одна в одній.
При розчиненні як рідин, так і твердих речовин спостерігається виділення або поглинання тепла. Іноді при змішуванні рідин відбувається зменшення об'ємів, так звана контракція.
За характером розчинника розрізняють водні і неводні розчини.
За точністю виразу концентрації розчини бувають приблизні, точні і емпіричні.
Концентрації розчинів.
Концентрації виражають в масових (вагових) і об'ємних (для рідин) відсотках, в моль або грам-еквівалентах, що містяться в одиниці об'єму розчину, а також титром і моляльністю.
| Концентрація в масових частках (відсотках) - вміст розчиненої речовини в грамах в 100 г розчину. | 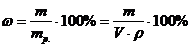
|
| Молярність - кількість моль розчиненої речовини, що міститься в 1 л розчину. | 
|
| Нормальність - кількість грам-еквівалентів розчиненої речовини в 1 л розчину. | 
|
Перевід нормальної концентрації в молярну здійснюється за формулою 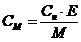 .
.
Молярна і нормальна концентрації зв’язані з масовою часткою:
 ;
;  .
.
Титр - вміст речовини в грамах в 1 мл розчину, г/мл. Наприклад, якщо в 1 л сульфатної кислоти з концентрацією 1 н. міститься 49,04 г H2SO4, то титр становить
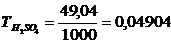 г/мл.
г/мл.
Моляльність - кількість моль розчиненої речовини, що міститься в 1000 г розчинника.
Зв’язок між масою розчину і розчиненої в ньому речовини виражають певними математичними рівняннями. Розв'язання цих рівнянь дає змогу встановити кількісний склад розчину.
Між масою m розчину, масовою часткою ω % і масою mp.p. чиненої речовини існує пропорційна залежність:
100 г розчину містять ω г розчиненої речовини,
m г розчину містять mp.p. г розчиненої речовини,
за якою можна скласти рівняння
mω = 100 mp.p.. (1)
Маса m розчину, його густина ρ та об'єм V взаємозв'язані:
m = Vρ. (2)
Підставивши значення m з рівняння (2) у рівняння (1), отримаємо
Vρω = 100 mp.p.. (3)
Для розчинів молярних концентрацій С (або молярних концентрацій еквівалентів Секв) об'єм V розчину пов'язаний з масою mp.p. розчиненої речовини та молярною масою М (масою Е одного еквівалента) рівняннями
mp.p. = СМV; (4)
mp.p.= С екв ЕV. (5)
Для розчинів моляльних концентрацій маса mp.p розчиненої речовини і маса М одного її моля пов'язана з моляльністю с і масою тp розчинника рівнянням
1000 mp.p = тpсМ. (6)
Маса m розчину дорівнює сумі мас mp.p розчиненої речовини і тp розчинника:
m = mp.p + тp. (7)
Об'єм розчину, як правило, не дорівнює сумі об'ємів розчинника і розчиненої речовини. Тому ні за масами, ні за об'ємами, взятих для приготування розчину речовин, не можна обчислити об'єм розчину. Об'єм розчину визначають експериментально або обчислюють за відповідними даними за рівнянням (2). У рівняннях (2) і (3) об'єм V виражено в мілілітрах, а в рівняннях (4) і (5) — у літрах. Маси виражають у грамах.
Під час приготування розчинів не можна виливати відразу всю воду в ємність. Водою споліскують кілька разів той посуд, в якому проводилося зважування або відмірювання потрібної речовини, і кожного разу додають цю воду в колбу для кількісного перенесення речовини.
Точні розчини.
Для розрахунків використовують точні атомні маси елементів. В результаті залишають стільки цифр після коми, скільки їх є в доданку з найменшим числом десяткових знаків. Зважують кількість на аналітичних терезах, в бюксі або годинниковому склі.
Зважену кількість речовини висипають в чисто вимиту мірну колбу через чисту суху лійку невеликими порціями. Потім з промивалки кілька разів невеликими порціями води обмивають над лійкою бюкс, в якому проводилося зважування. Лійку також кілька разів обмивають з промивалки дистильованою водою. Розчинник (вода) при цьому повинен займати не більше половини місткості колби. Закривши пробкою мірну колбу, струшують її до повного розчинення твердої речовини. Після цього отриманий розчин доливають водою до мітки і ретельно перемішують.
Для приготування 1 л 1 М розчину речовини відважують на аналітичних терезах 1 моль речовини, вміщують її в колбу місткістю 1 л, розчиняють у воді і доводять до мітки. Для приготування 1 н. розчину відважують 1 грам-еквівалент речовини. Напівнормальний (0,5 н.), децинормальний (0,1 н.), сантинормальний (0,01 н.) готують за тим же принципом.
Після приготування розчину треба перевірити його концентрацію титруванням відповідним розчином іншої речовини з відомою нормальністю.
Розрахунок наважки для приготування розчину для титрування проводять за формулою:
 ,
,
де а – маса наважки, г; Ер — величина грам-еквівалента речовини, що розчиняється, г; Т - титр розчину за визначуваною речовиною, г/мл; V - заданий об'єм розчину, мл; Е0 - величина грам-еквівалента визначуваної речовини, г.
Наприклад, необхідно приготувати 3 л розчину КМnО4 з титром за залізом 0,0050 г/мл. Е (КМnО4) = 31,61 г, Е (Fе) = 55,847 г.
а = 31,61∙0,005∙3000/(55,847∙1000)
Щоб отримати вміст чистої речовини (г) у взятій для аналізу кількості розчину, необхідно помножити об'єм розчину, що пішов на титрування, на титр розчину.
а = VТ
Стандартними називаються розчини з різними точно відомими концентраціями розчиненої речовини.
Кількість речовини (г), необхідну для приготування стандартних розчинів, обчислюють за формулою:
 ,
,
де М1 - молекулярна маса речовини, що розчиняється;
Т - титр розчину по визначуваній речовині, г/мл;
V - заданий об'єм розчину, мл;
М2(А) — молекулярна або атомна маса визначуваної речовини.
Емпіричні розчини - їх концентрацію виражають в г/л або г/мл.
Фіксанали - наперед приготовані і запаяні в скляних ампулах точно відважені кількості реактиву, необхідні для приготування 1 л 0,1 н. або 0,01 н. розчину.
Їх використовують для швидкого приготування точних розчинів. Дуже старі (2-3 роки) лужні фіксанали можуть бути неточними в результаті забруднення продуктами вилужнювання скла. Інші можуть зберігатися дуже довго.
Для приготування точного розчину змивають напис на ампулі, обтирають її та споліскують дистильованою водою. В мірну колбу на 1 л вставляють спеціальну лійку з вкладеним в неї скляним бойком (є в коробці), гострий кінець якого повинен бути направлений вгору. Коли бойок правильно вкладений в лійку, ампулу з фіксаналом ударяють, так, щоб тонке дно ампули розбилося при ударі об гострий кінець бойка. Після цього пробивають бічне поглиблення ампули і дають вмісту ампули витекти. Потім, не змінюючи положення ампули, її ретельно промивають дистильованою водою з промивалки. Для промивки використовують шестикратну (відносно місткості ампули) кількість води. Промивши ампулу, її викидають, а розчин доводять водою до мітки, закривають колбу пробкою і струшують.
ПРИКЛАДИ ЗАДАЧ
Приклад 1. Обчислити, скільки 20%-го розчину Н2SО4, потрібно для приготування по 5 л її розчинів: а) 0,1 М; б) 0,1 н.; в) 6%-го.
Розв'язування. Обчислимо масу чистої Н2SО4 в розчинах, які потрібно приготувати.
Для першого розчину знайдемо її за рівнянням (4): mp.p. = 0,1 • 98 • 5 = 49 г Н28О4;
для другого - за рівнянням (5): mp.p. = 0,1 • 49 • 5 = 24,5 г Н2SО4;
для третього - спочатку визначимо масу розчину за рівнянням (2): m = 5000х1,040 г/см3 = 5200 г (густину 1,040 г/см3 взято з довідника), а далі масу чистої Н2SО4 mp.p. — за рівнянням (1):
mp.p. = 5200•6/100 = 312 г Н2SО4.
Потім за рівнянням (1) обчислимо, в якій масі 20%-го розчину Н2SО4 містяться потрібні маси чистої Н2SО4 в кожному з розчинів:
а) m1 = 100•49/20 = 245 г 20%-го розчину Н2SО4;
б) m2 = 100•24,5/20 = 122,5 г 20%-го розчину Н2SО4;
в) m2 = 100•312/20= 1560 г 20%-го розчину Н2SО4.
Щоб перевести маси 20 %-го розчину Н2SО4, беруть густину (з довідника) такою, що дорівнює 1,143 г/см3, тоді об'єми обчислюють за рівнянням (2):
а) V1 = 245/1,143 = 214,4 мл 20%-го розчину Н2SО4;
б) V2 = 122,5/1,143 = 107,2 мл 20%-го розчину Н2SО4;
в) V3 = 1560/1,143 = 1362,5 мл 20%-го розчину Н2SО4.
Для приготування першого і другого розчинів води додають стільки, щоб об'єми розчинів стали однаковими і кожен дорівнював 5 л. Для приготування 5 л 6%-го розчину масою 5200 г за рівнянням (6) потрібно до маси 1560 г 20%-го розчину Н2SО4 додати 5200—1560 = 3440 г води.
Приклад 2. Розчин густиною 1,185 г/см3 містить 25,4% сульфатної кислоти. Обчислити молярність і молярну концентрацію еквівалента цього розчину.
Розв'язування. Маса 1 л розчину за рівнянням (2) дорівнює:
m = 1000 • 1,185 = 1185 г,
а маса розчиненої в ньому Н2SО4 за рівнянням (1):
mp.p. = 1185 • 25,4/100 = 301,0 г Н2SО4.
Молярність розчину і молярну концентрацію еквівалента обчислимо відповідно за рівняннями (4) і (5):
С = 301,0 /98•1 =3,071 моль/л;
Секв = 301,0 /49•1 = 6,142 моль/л.
Приклад 3. Визначити молярну і нормальну концентрацію розчину, в якому масова частка сульфатної кислоти 12% (густина 1,08 г/см3).
Розв'язування. Знаходимо молекулярну і еквівалентну масу кислоти:
М (Н2SО4) = 98 г/моль; Е (Н2SО4) =  г/моль.
г/моль.
Використовуючи формули для переводу концентрацій, знаходимо:
 ;
;
 .
.
Приклад 4. По скільки мл 0,5 М і 0,1 М розчинів треба змішати для одержання 1000 мл 0,2 М розчину?
Розв'язування. Знаходимо співвідношення частин розчинів за правилом хреста:
0,5 0,1
\ /
0,2
/ \
0,1 0,3
Отже, співвідношення частин 0,5 М і 0,1 М розчинів становить 0,1:0,3 або 1:3, тобто, всього 3+1=4 (частини). Тоді:
V(0,5 M) = 1∙1000/4 = 250 (мл);
V(0,1 M) = 3∙1000/4 = 750 (мл);
Лабораторна робота
Тема: Приготування розчинів різної концентрації.
Мета: навчитися готувати розчини точної та приблизної концентрації.
Обладнання, матеріали: технічні ваги, стакан, скляна паличка, конічна колба, мірна колба місткістю 1 л, лійка, мірний циліндр, бюретка, піпетка Мора на 5 мл, NaOH (KOH), фіксанал сульфатної кислоти (0,1 н.), індикатор метиловий червоний.
Правила техніки безпеки: дотримуватись правил роботи з кислотами та лугами, обережно працювати зі склом.
Опорні знання:
За точністю вираження концентрації розрізняють п р и б л и з н і та т о ч н і розчини.
Для приготування приблизних розчинів користуються масовою концентрацією розчиненої речовини. Маса наважки речовини для приготування розчину з масовою концентрацією розраховується за формулою:
 .
.
Маса води, необхідна для приготування розчину з масовою концентрацією, розраховується за формулою:

 .
.
Цифри в розрахунках можна заокруглювати, наважку брати на технічних вагах, воду додавати за допомогою мірного циліндра.
Для приготування точних розчинів користуються молярною або нормальною концентрацією розчиненої речовини. Маса наважки речовини для приготування розчину з молярною концентрацією розраховується за формулою:
m=CM∙M∙V.
Маса наважки речовини для приготування розчину з нормальною концентрацією розраховується за формулою:
m=Cекв∙Е∙V.
Результати розрахунків треба виражати числами з декількома знаками після коми, наважку брати на аналітичних вагах, розчини готувати в мірних колбах.
Можна встановити точну концентрацію приблизного розчину титруванням розчином з відомою точною концентрацією. Концентрація розчину розраховується за формулою:
 .
.
 Рисунок 1 - Пристосування для приготування розчинів з фіксаналу:
1 – ампула фіксаналу; 2 – бойок; 3 – лійка; 4 – бойок; 5 – колба.
Рисунок 1 - Пристосування для приготування розчинів з фіксаналу:
1 – ампула фіксаналу; 2 – бойок; 3 – лійка; 4 – бойок; 5 – колба.
| Для швидкого приготування точних розчинів зручно використовувати фіксанали – запаяні скляні ампули з точно зваженим реактивом для приготування 1 л 0,1 н. або 0,01 н. розчину (див. рис. 1). Кожна ампула має напис з назвою речовини та концентрацією 1 л розчину. Перед застосуванням ампули цей напис треба змити та сполоснути ампулу дистильованою водою. Для приготування розчину речовини вказаної концентрації в горло мірної колби місткістю 1 л вміщують лійку, в лійку вставляють бойок. Розбивають нижню частину ампули, пробиваючи нижнє поглиблення ампули об бойок. Другим бойком розбивають верхню частину ампули. Не змінюючи положення ампули дають її вмісту витекти або висипатися в колбу через лійку. |
Ретельно промивають ампулу дистильованою водою з промивалки. Ампулу викидають у сміття. Змивають рештки речовини з лійки. Виймають лійку з бойком з горла колби. Перемішують круговими рухами вміст колби. Доводять дистильованою водою до мітки та ретельно перемішують вміст колби.
Методичні рекомендації щодо виконання та оформлення:
При виконанні роботи строго дотримуватися кількостей реагентів та методики виконання, вказаної в інструкції, а також правил техніки безпеки.
Зміст і послідовність виконання завдання:
Приготування розчину лугу приблизної концентрації, розчину кислоти точної концентрації з фіксаналу, встановлення концентрації лугу титруванням кислотою
1. Приготувати 0,1 н. розчин Н2SO4 з фіксаналу.
- Розрахувати масу наважки для приготування 50 мл 0,2 н. розчину NaOH (KOH) з точністю до 0,1 г.
- Розраховану за п. 2 наважку NaOH (KOH) зважити на технічних вагах, помістити у стакан.
- Прилити у стакан з наважкою за допомогою мірного циліндра 50 мл дистильованої води, розчинити луг, перемішуючи вміст стакану скляною паличкою.
- Заповнити бюретку розчином кислоти, приготованим за п. 1.
- Піпеткою Мора відібрати аліквоту розчину лугу об’ємом 5 мл, перенести в конічну колбу.
- Додати в конічну колбу за допомогою мірного циліндра 10 мл дистильованої води та 2-3 краплі метилового червоного.
- Титрувати вміст конічної колби розчином кислоти з бюретки до переходу жовтого забарвлення у малинове.
- Провести ще 2 титрування аналогічно п.п. 6-8. Результати занести в таблицю 1.
- Розрахувати нормальність лугу, використовуючи одержані дані, за формулою:
 ,
,
де С екв (H2SO4) - концентрація сульфатної кислоти, приготованої з фіксаналу, дорівнює 0,1 н.;
V(H2SO4) – середній об’єм сульфатної кислоти, що пішов на титрування (з таблиці 1);
V(NaOH) - аліквота лугу, дорівнює об’єму піпетки Мора, тобто 5 мл.
Результат розрахувати з точністю до 4-х знаків після коми.
Таблиця 1. Результати титрування лугу сульфатною кислотою.
| № титрування | Об’єм 0,1 н. H2SO4, що пішов на титрування, мл |
| Середнє значення трьох результатів |
Після виконання лабораторної роботи студент повинен:
| Знати: Типи розчинів, техніку приготування приблизних та точних розчинів, формули розрахунків для приготування розчинів | Вміти: Розрахувати наважки для приготування розчинів різних типів, приготувати приблизні та точні розчини, приготувати розчин з фіксаналу, визначити концентрацію розчину титруванням розчином з відомою точною концентрацією. |
Контрольні питання
- Що таке розчинення?
- Які існують типи розчинів?
- Формули розрахунків для приготування розчинів заданої концентрації.
- Техніка приготування приблизних та точних розчинів.
- Фіксанали. Приготування розчинів з фіксаналів.
Задачі
- Яку наважку речовини та скільки г води треба взяти для приготування:
А. 150 г 3 %-ного розчину;
Б. 100 г 1,5 %-ного розчину;
В. 50 г 2 %-ного розчину;
Г. 25 г 1 %-ного розчину?
- Скільки води потрібно додати до 200 мл 1 н. розчину сульфатної кислоти, щоб утворився 0,2 н. розчин?
- Обчисліть у відсотках, скільки безводної солі СuSО4 міститься в 400 г 3%-го розчину СuSО4 • 5Н2О.
- Знайдіть молярність 22%-го розчину хлоридної кислоти, густина якої дорівнює 1,110.
- Скільки мілілітрів 30%-го розчину хлоридної кислоти густиною 1,152 г/см3 потрібно для приготування 0,5 л 2 н. її розчину?
- Визначте молярну концентрацію еквівалента речовини у розчині, який містить 20 г магній сульфату в 0,5 л води.
- Скільки грамів Н3РО4 потрібно для приготування 0,5 л 0,01 н. її розчину?
- Обчисліть молярну концентрацію еквівалента 10%-го розчину їдкого натру, якщо його густина дорівнює 1,2 г/см3.
- Знайдіть молярну концентрацію10%-ного розчину натрій гідроксиду з густиною 1,04 г/мл.
- Яка масова частка хлоридної кислоти в 2М розчині з густиною 1,19 г/мл?
- Скільки грамів 25%-ного розчину КОН потрібно додати до 400 мл води, щоб отримати 15%-ний розчин?
- Скільки л 2 н. розчину сульфатної кислоти можна приготувати з 100 г 96%-ного розчину?
2.3. Перекристалізація.
Усі речовини, як правило, забруднені домішками інших речовин. Абсолютно чистих речовин практично немає.
Для характеристики ступеня чистоти речовин, які виготовляє хімічна промисловість, застосовують спеціальні назви: «технічна», «чиста», «чиста для аналізу» і «хімічно чиста». Кожній назві відповідає максимально допустимий за державними стандартами вміст речовин у вигляді домішок. Найбільш забруднений домішками «технічний» продукт. Зі збільшенням ступеня чистоти дістаємо «чистий», «чистий для аналізу» і «хімічно чистий» продукт. Останній відповідає максимально можливому ступеню чистоти, якого можна досягти в заводських умовах.
Незначні домішки можуть різко впливати на певні властивості основних речовин, тому часто необхідно додатково очищувати реактиви. Речовини, призначені для спеціальних цілей, доводиться очищати різними специфічними методами.
Один з методів очищення речовин – п е р е к р и с т а л і з а ц і я.
Кристалізація - виділення розчиненої речовини при охолоджуванні гарячого насиченого розчину. Чим нижче температура, до якої охолоджують розчин, тим більше кількість кристалів випадає в осад.
Рідина, яку після нього можна відділити від осаду фільтруванням (так званий маточний розчин), буде все ж таки насиченим при даній температурі розчином, з якого можна додатково виділити деяку кількість розчиненої речовини або при більш сильному охолоджуванні, або шляхом упарювання, тобто видаляючи деяку частину розчинника.
Якщо в розчині знаходиться декілька різних речовин, то вони можуть бути розділені так званою дробовою кристалізацією. Така можливість пояснюється неоднаковою розчинністю речовин при різних температурах. При деякій певній температурі розчин буде насиченим відносно однієї і ненасиченим відносно іншої речовини. В той час, як перша речовина стане при охолоджуванні випадати в осад, друга ще повністю знаходитиметься в розчині.
Щоб перекристалізувати речовину, її розчиняють у відповідному розчиннику, нагрітому до кипіння, прагнучи отримати концентрований або навіть насичений при даній температурі розчин. Якщо розчин містить механічні домішки або каламуть, його фільтрують через лійку для гарячого фільтрування, приймачем може бути кристалізатор, фарфорова чашка, конічна колба або стакан. Якщо ж розчин прозорий і не містить механічних домішок, фільтрування недоречне, оскільки пов'язано з втратою речовини.
При перекристалізації прагнуть отримати речовину в кристалах середнього розміру. Крупні кристали звичайно містять включення маточного розчину з домішками, що знаходяться в ньому. Дуже дрібні кристали, вільні від цих включень, утворюють густу кашку, між окремими кристалами яких міцно утримується маточний розчин, відмити який повністю без втрати речовини не вдається. Крім того, встановити кристалічну структуру дуже дрібних кристалів важко, а це позбавляє можливості використовувати критерії чистоти речовини - його кристалічну структуру і однорідність утворених кристалів. Рекомендують одержувати кристали таких розмірів, щоб структура їх була чітко видна при збільшенні в 50-100 разів. Величина окремих кристалів залежить від швидкості охолоджування. Якщо розчин охолоджується поволі, то кристали, що утворюються, поступово ростуть і досягають великих розмірів. При швидкому охолодженні утворюються дрібні кристали.
Для швидкого охолодження розчину кристалізатор поміщають в холодну воду або лід. Якщо при швидкому охолоджуванні кристали не виділяються, утворення їх можна викликати тертям скляною паличкою зсередини об стінку судини або ж внести невелику кількість чистої речовини в охолоджений розчин.
Якщо при кристалізації утворилися дуже дрібні кристали, їх знову розчиняють при нагріванні, а судину, в якій проводилося розчинення, одразу ж обгортають рушником, накривають годинниковим склом (опуклою стороною назовні) і залишають стояти в повному спокої.
Утворену при кристалізації речовину відділяють від маточного розчину шляхом фільтрування під вакуумом; ретельно віджимають пласкою стороною скляної пробки і промивають невеликою кількістю чистого холодного розчинника. Маточний розчин упарюють до половини і знову виділяють нову порцію речовини.
Відфільтровані кристали висипають на фільтрувальний папір, рівномірно розподіляють по ньому, зверху закривають іншим листом фільтрувального паперу і сушать на повітрі. Якщо речовина не втрачає кристалізаційної води, то її можна сушити в ексикаторі. Речовини, що розпливаються на повітрі, швидко віджимають на пористій глиняній тарілці і перекладають в скляну банку з притертою пробкою.
Після фільтрування гарячого розчину фільтр промивають невеликою кількістю чистого нагрітого розчинника. Таким чином зменшують втрату речовини, що кристалізується.
Для охолодження до температури 0°С застосовуються так звані охолоджувальні суміші. Приклад охолоджувальних сумішей:
· сніг: NаСl = 3: 1 [-21°С];
· СаСl2 • 7H2О: сніг = 1,5: 1 [-55°С];
· тверда вуглекислота (сухий лід): діетиловий ефір [-78°С];
· рідкий азот [-198°С].
Зріджені гази зберігають і перевозять в судинах Дьюара. Це скляні двостінні судини різної форми, причому простір між стінками вакуумований, а стінки судин посріблені, або ж металеві судини. На кожній судині є напис, який газ міститься в ній. Існують інструкції з техніки безпеки при користуванні дьюарівськими судинами для зберігання зріджених газів і роботи з ними.
Лабораторна робота
Тема: Перекристалізація нітрату натрію
Мета: навчитися очищувати речовини методом перекристалізації.
Обладнання, матеріали: натрій нітрат NaNO3, технохімічні ваги, 2 стакани місткістю 100 мл, стакан місткістю 250 мл, скляна паличка, лійка, фільтрувальний папір, електроплитка, дистильована вода, сушильна шафа.
Правила техніки безпеки: дотримуватись правил роботи з електронагрівальними приладами.
Опорні знання:
Для проведення перекристалізації речовину розчиняють в гарячому розчиннику, щоб одержати насичений розчин. Якщо одержаний розчин каламутний, його фільтрують. Насичений розчин швидко охолоджують для випадіння кристалів. Для покращення кристалізації потирають скляною паличкою стінки посуду. Кристали, що утворилися, відфільтровують під вакуумом та промивають холодним розчинником. Відфільтровані кристали віджимають, розподіляють на фільтрувальному папері та сушать на повітрі, в ексикаторі чи в сушильній шафі.
Не нашли, что искали? Воспользуйтесь поиском: