
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Калорическое и термическое уравнения состояния системы
Уравнение (П.4.1) является универсальным, и, в этой связи, применимым для всех типов макроскопических систем. Однако, даже для простейшего случая термодинамической системы (идеальный газ)
   , ,
| (П.4.2) |
это уравнение является неразрешимым, поскольку содержит пять переменных 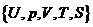 . Следовательно, его практическое применение для конкретной термодинамической системы сопряжено с необходимостью дополнения к этому уравнению ряд дополнительных соотношений, характеризующих специфику рассматриваемой системы.
. Следовательно, его практическое применение для конкретной термодинамической системы сопряжено с необходимостью дополнения к этому уравнению ряд дополнительных соотношений, характеризующих специфику рассматриваемой системы.
Для изыскания этих соотношений следует обратить внимание на тот факт, что равновесные внутренние параметры системы являются функциями внешних параметров и температуры системы, что приводит к существованию термических и калорических уравнений состояния системы. Эти дополнительные уравнения должны связывать температуру T и внешние параметры ai с каким либо внутренним параметром bk термодинамической системы:
  
| (П.4.3) |
Если в качестве внутреннего параметра bk выступает непосредственно внутренняя энергия системы U (т.е.: bk = U), то получается калорическое уравнение состояния системы:
  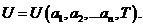
| (П.4.4) |
Своим названием калорическое уравнение состояния обязано тому обстоятельству, что с его помощью можно находить теплофизические характеристики материалов, например, теплоемкость веществ.
Если же внутренним параметром bk является сопряженная внешнему параметру ai обобщенная сила Ai (т.е. bk = Ai), то получается термическое уравнение состояния системы:
   где: i = 1, 2,… n. где: i = 1, 2,… n.
| (П.4.5) |
Своим названием термическое уравнение состояния обязано тому обстоятельству, что с его помощью можно находить температуру системы.
Общее число термических и калорических уравнений состояния системы равно числу ее степеней свободы, т.е. числу независимых параметров однозначно характеризующих состояние системы. Согласно постулатам равновесной термодинамики калорическое и каждое из термических уравнений состояния системы не являются независимыми (связаны дифференциальным уравнением в частных производных).
Если калорическое и все термические уравнения состояния системы известны, то далее, с помощью теоретического аппарата термодинамики, можно определить все термодинамические свойства системы. Важно отметить, что вывести (теоретическим путем) упомянутые выше уравнения состояния системы с помощью методов термодинамики не представляется возможным. Эти уравнения устанавливаются либо опытным путем, либо – с помощью теоретического аппарата статистической физики.
Методологические принципы практического использования калорического и термических уравнений состояния удобно проиллюстрировать на примере анализа простейшей термодинамической системы – «идеальный газ», для которой эти уравнения имеют соответственно вид (обратить внимание на то, что система имеет две степени свободы):
 (термическое уравнение). (термическое уравнение).
| (П.4.6.а) | |
 (калорическое уравнение). (калорическое уравнение).
| (П.4.6.б) |
Если принять в качестве обобщенной силы  (давление газа) и сопряженную этой силе обобщенную координату
(давление газа) и сопряженную этой силе обобщенную координату 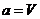 (объем газа), то уравнения состояния приобретают вид:
(объем газа), то уравнения состояния приобретают вид:
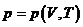 (термическое уравнение). (термическое уравнение).
| (П.4.7.а) | |
 (калорическое уравнение). (калорическое уравнение).
| (П.4.7.б) |
Для идеального газа термическим уравнением состояния является известное уравнение Клайперона-Менделеева (определено эмпирическим путем!):
 (термическое уравнение). (термическое уравнение).
| (П.4.8) |
Обратить внимание на то обстоятельство, что наличие выражения (П.4.8) уменьшает число степеней свободы термодинамической системы на единицу.
Используя закон Джоуля о независимости внутренней энергии идеального газа от его объема при постоянной температуре (т.е. исключается из рассмотрения потенциальная энергия взаимодействия атомов газа между собой:  ), для калорического уравнения имеем:
), для калорического уравнения имеем:
 , ,
| (П.4.9) |
где  - теплоемкость газа при постоянном объеме.
- теплоемкость газа при постоянном объеме.
Согласно опытным данным, теплоемкость  не зависит от температуры газа (элемент идеализации в постановке задачи), поэтому, в результате интегрирования выражения (П.4.9), для калорического уравнения имеем:
не зависит от температуры газа (элемент идеализации в постановке задачи), поэтому, в результате интегрирования выражения (П.4.9), для калорического уравнения имеем:
 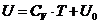 , ,
| (П.4.10) |
где  - постоянная интегрирования, зависящая только от типа рассматриваемого газа.
- постоянная интегрирования, зависящая только от типа рассматриваемого газа.
Рассмотренный случай («идеальный газ») является самым простым в практике анализа термодинамических систем. Уже для случая «реальных газов» (не говоря уж о конденсированных средах) трудности нахождения уравнений состояния системы неизмеримо возрастают. Именно это обстоятельство является сдерживающим фактором на пути широкого использования (внедрения) теоретических подходов равновесной термодинамики в производственно-техническую практику, связанную с созданием устройств электронной техники.
Не нашли, что искали? Воспользуйтесь поиском: