
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Основные свойства ферментов.
Высокая активность в мягких биологических условиях. Скорости реакций, катализируемых ферментами, в сотни тысяч – миллионы раз. Это связано с тем, что ферменты проводят реакцию по пути с очень низкой энергией активации.
Специфичность действия. Каждый фермент действует на строго определенные молекулы в качестве субстратов, осуществляя только одну строго определенную химическую реакцию. Так как активный центр комплементарен только своему субстрату.
Регулируемость. Активность ферментов регулируется гормонами, субстратами и другим регуляторами. В ходе регуляции изменяется конформация фермента.
Фермент в ходе реакции все время подстраивается под переходное состояние субстрата, понижая его энергию. Реакция с участием фермента идет по другому механизму с гораздо более низкой энергией активации.

По уравнению Аррениуса k=koe- Ea/RT константа скорости экспотенциально возрастает при снижении энергии активации.
Ферменты не только снижают энергию активации процесса, но увеличивают скорость реакции, повышая ko (предэкспоненту). В активном центре происходит «правильная» ориентация субстратов, что увеличивает вероятность эффективного соударения.
Активность фермента – это скорость, катализируемой им реакции. Чаще всего активность измеряется в ммоль/л. час.
Применительно к лекарственным препаратам, содержащим ферменты, часто пользуются международной единицей активности (МЕД ) - это количество фермента, катализирующее превращение субстрата со скоростью 1 мкмоль/мин.
Также используют удельную активность фермента – содержание международных единиц активности фермента на 1 мг белка в препарате. Еще одной международной единицей активности ферментов являетсяе катал. Катал – это количество фермента, катализирующее превращение 1 моль субстрата в продукт за 1 сек. 1 кат=6*107 МЕД.
Чтобы фермент мог осуществлять свои функции он должен находиться в нативной (природной) конформации. Утрата этой конформации называется – денатурация. Денатурацию могут вызывать повышение или понижение температуры, повышение концентрации солей, изменение рН среды и другие факторы. Денатурация бывает обратимой и необратимой. Примером необратимой денатурации может быть ковалентное связывание фермента ацетилхолинэстеразы с боевым отравляющим веществом Диизопропилфторфосфатом. Ацетилхолинэстераза участвует в передаче нервного импульса, поэтому диизопропилфторфосфат – нейропарализующий яд. 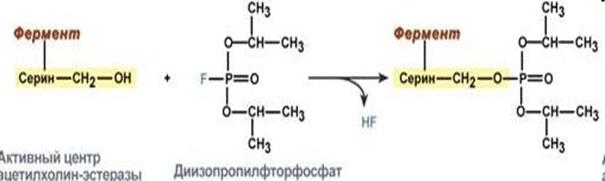
По этому же механизму действуют ионы Hg2+, Pb2+, мышьяковистые соединения, некоторые инсектициды, дефолианты и другие яды. Примером обратимой денатурации можно считать повышение концентрации солей или понижение температуры.
Не нашли, что искали? Воспользуйтесь поиском: