
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Зависимость активности фермента от температуры
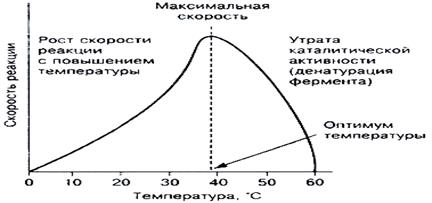
Приповышении температуры активность фермента повышается. Дальнейшее повышение температуры ухудшает каталитические возможности фермента, наступает тепловая денатурация фермента. Поэтому зависимость v(T) имеет колоколообразный вид, с резким падением активности в области высоких температур. Термическая устойчивость для разных ферментов – разная. К термически неустойчивым относятся, например, киназы, теряющие активность при 43оС. Есть ферменты устойчивые до 100оС. Такая устойчивость характерна для бактериальной ДНК полимеразы, использующейся для ДНК диагностики (полимеразной цепной реакции, ПЦР).
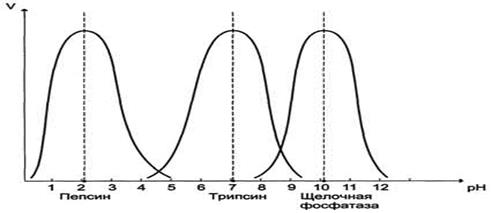
Зависимость скорости ферментативной реакции от рН:
рН характеризует кислотность среды. Чем меньше рН,тем более кислая среда.
При протонировании белка меняется его пространственная структура и ферментативная активность. Большинство ферментов имеют оптимум активности при рН близком к 7 (нейтральной среде). Однако, как видно на рисунке оптимум пепсина лежит в кислой среде
(рН~2), а оптимум щелочной фосфатазы в щелочной среде (рН~10).
При добавлении кислоты к ферменту происходит протонирование ряда аминокислот. Это может привести к изменению пространственной структуры фермента, или к изменениям в активном центре. Есть ферменты которые очень чувствительны к изменению рН, а есть такие, которые работают в широком диапазоне рН. Представим себе активный центр фермента. Его задача, подстраиваясь под переходное состояние фермента максимально снизить энергию переходного состояния субстратов (энергию активации). Для этого вокруг тех связей, которые должны разорваться размещаются электроакцепторные группы аминокислот, а там где должны образоваться связи – электродонорные группы. В ферментах протеидах в ферментативном катализе участвуют коферменты. Для ферментативного катализа характерны следующия подходы:
1.Ферменты специфически связывают субстраты в активном центре. При этом субстраты ориентируются таким образом, что приобретают оптимальное положение для образования переходного состояния.
2. Кроме того, происходит удаление гидратной оболочки субстрата. В результате создаются совершенно другие условия, чем в растворе.
3. Вследствие взаимодействия между аминокислотными остатками белка и субстратом происходит стабилизация переходного комплекса ЕS.
4. Часто осуществляется перенос протонов. Это ферментативный кислотно-основной катализ.
5. Часто химические группировки ковалентно присоединяются к остаткам фермента. Это явление называют ковалентным катализом.
6. Взаимодействие с радикалами аминокислот вызывают деформацию субстрата, (деформационный катализ), что облегчает протекание процесса.
Не нашли, что искали? Воспользуйтесь поиском: