
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
1 страница. Красноярский государственный технический университет
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Красноярский государственный технический университет
ХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ И КОНТРОЛЬНЫЕ ЗАДАНИЯ
Для студентов заочников инженерно-технических (нехимических) специальностей высших учебных заведений
Красноярск 2008
УДК 546/(076.1)
Г52
Г52 Химия. Методические указания и контрольные задания: для студентов заочников инженерно-технических (нехимических) специальностей высших учебных заведений /Сост. Е. В. Грачева, В. Е. Лопатин, Л. В. Фоменко. Красноярск: СФУ, 2008. 118 с.
Рекомендуется для студентов заочного факультета, обучающимся по дистанционным технологиям
Печатается по решению Редакционно-издательского совета университета
© СФУ, 2008
ВВЕДЕНИЕ
Инженер любой специальности должен обладать достаточными знаниями в области химии. Изучение курса химии способствует развитию логического химического мышления, позволяет получить современное научное представление о материи и формах ее движения, о веществе как одном из видов движущейся материи, о механизме превращения химических соединений. Необходимо прочно усвоить основные законы и теории химии и овладеть техникой химических расчетов, выработать навыки самостоятельного выполнения химических экспериментов и обобщения наблюдаемых фактов. Знание химии необходимо для успешного изучения последующих общенаучных и специальных дисциплин.
Основной вид учебных занятий студентов-заочников – самостоятельная работа над учебными материалами. По курсу химии она слагается из следующих элементов: изучение материала по учебникам и учебным пособиям; выполнение контрольных заданий; выполнение лабораторного практикума; индивидуальные консультации; посещение лекций; сдача зачета по лабораторному практикуму; сдача экзамена по всему курсу.
Работа с книгой. Изучать курс рекомендуется по темам, предварительно ознакомившись с содержанием каждой из них. (Расположение материала курса в программе не всегда совпадает с расположением его в учебнике). Изучая курс, обращайтесь и к предметному указателю в конце книги. При первом чтении не задерживайтесь на математических выводах, составлении уравнения реакций: старайтесь получить общее представление об излагаемых вопросах, а также отмечайте трудные или неясные места. Внимательно прочитайте текст, выделенный шрифтом. При повторном изучении темы усвойте все теоретические положения, математические зависимости и их выводы, а также принципы составления уравнения реакций. Вникайте в сущность того или иного вопроса и не пытайтесь запомнить отдельные факты и явления. Изучение любого вопроса на уровне сущности а не на уровне отдельных явлений способствует более глубокому и прочному усвоению материала. Чтобы лучше запомнить и усвоить изучаемый материал, надо обязательно иметь рабочую тетрадь и вносить в нее формулировки законов и основных понятий химии, новые незнакомые термины и названия, формулы и уравнения реакций, математические зависимости и их выводы и т. п. Во всех случаях, когда материал поддается систематизации, составляйте графики, схемы, диаграммы, таблицы. Они очень облегчают запоминание и уменьшают объем конспектируемого материала. Пока тот или иной раздел не усвоен, переходить к изучению новых разделов не следует. Краткий конспект курса будет полезен при повторении материала в период подготовки к экзамену. Изучение курса должно обязательно сопровождаться выполнением упражнений и решением задач. Решение задач – один из лучших методов прочного усвоения, проверки и закрепления теоретического материала.
Контрольные задания. В процессе изучения курса химии студент должен выполнить одну или две контрольные работы. К выполнению контрольной работы можно приступить только тогда, когда будет изучена определенная часть курса и тщательно разобраны решения примеров.
Решение задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы, за исключением тех случаев, когда по существу вопроса такая мотивировка не требуется, например, когда нужно составить электронную формулу атома, написать уравнение реакции и т. п. При решении задач нужно приводить весь ход решения и математические преобразования.
Контрольная работа должна быть аккуратно оформлена; для замечаний рецензента надо оставлять широкие поля; писать четко и ясно; номера и условия задач переписывать в том порядке, в каком они указаны в задании. В конце работы следует дать список использованной литературы с указанием года издания. Работа должна быть датирована, подписана студентом и представлена в университет на рецензирование.
Если контрольная работа не зачтена, ее нужно выполнить повторно в соответствии с указаниями рецензента и выслать на рецензию вместе с незачтенной работой. Исправление следует выполнить в конце тетради, а не в рецензированном тексте. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не зачитывается.
Лабораторные занятия. Для глубокого изучения химии как науки, основанной на эксперименте, необходимо выполнить лабораторные работы. Студенты, выполняют их в период экзаменационной сессии.
Консультации. Если у студента возникают затруднения при изучении курса, следует обращаться за консультацией к преподавателю, рецензирующему контрольные работы.
Лекции. В помощь студентам читаются лекции по важнейшим разделам курса. Студентам, не имеющим возможности слушать лекции одновременно с изучением курса по книге, лекции читаются в период экзаменационной сессии.
Зачет. Выполнив лабораторный практикум, студенты сдают зачет. Для сдачи зачета необходимо уметь изложить ход работы, объяснить результаты выполненных опытов и сделать выводы, уметь составлять уравнения реакций. Студенты, сдающие зачет, предъявляют лабораторную тетрадь с пометкой преподавателя о выполнении всех работ, предусмотренных планом практикума.
Экзамен. К сдаче экзамена допускаются студенты, которые выполнили контрольные задания и сдали зачет по лабораторному практикуму. Экзаменатору студенты предъявляют зачетную книжку, направление на экзамен и зачтенные контрольные работы.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 712135, две последние цифры 35, им соответствует вариант контрольного задания 35.
КОНТРОЛЬНОЕ ЗАДАНИЕ 1
Моль. Эквиваленты и молярные массы эквивалентов
простых и сложных веществ. Закон эквивалентов
Пример 1.
0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты – 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля.
Решение.
Эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в обменных реакциях или одному электрону в окислительно-восстановительных.
Масса одного эквивалента называется молярной массой эквивалента. Задачу решают по закону эквивалентов: «Массы (объемы) реагирующих друг с другом веществ пропорциональны молярным массам эквивалентов (объемам)»:
m1: m2 = Мэкв.1 : Мэкв.2.
В условии задачи количество выделившегося водорода дано в объемных единицах. Поэтому в выражении закона эквивалентов масса и молярная масса эквивалента газа заменяются объемом и молярным объемом эквивалента:
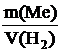 =
=  .
.
Молярный объем эквивалента водорода (объем, занимаемый молярной массой эквивалента газа при нормальных условиях):
22,4: 2 = 11,2 л/моль.
Рассчитываем молярную массу эквивалента металла:
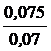 =
=  , Мэкв.(Me)=
, Мэкв.(Me)=  = 12 г/моль.
= 12 г/моль.
Зная молярную массу эквивалента металла, по закону эквивалентов можно определить молярную массу эквивалента никеля:
 =
=  ,
,  =
=  ,
,
Мэкв.(Ni)= 
 = 29,35 г/моль.
= 29,35 г/моль.
Пример 2.
При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида.
Решение.
Чтобы определить, какой металл был сожжен, рассчитаем молярную массу его эквивалента по закону эквивалентов:
 =
=  , Мэкв.(Ме)=
, Мэкв.(Ме)= 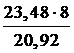 = 9 г/моль.
= 9 г/моль.
Молярная масса эквивалента кислорода равна 8 г/моль, а массу соединившегося с металлом кислорода определяем из соотношения:
m(Me2O3) = m(Me) + m(O2), m(O2) = 44,40 – 23,48 = 20,92 г.
Из формулы A(Me) = Мэкв.(Me) · n рассчитываем атомную массу металла:
AMe= 9 · 3 = 27 г.
По Периодической системе Д. И. Менделеева определяем, что металл с атомной массой 27 – алюминий. Формула оксида алюминия Al2O3. Его молярная масса эквивалента:
Мэкв.(Al2O3) = Мэкв.(Al) + Мэкв.(O2);
Мэкв.(Al2O3) = 9 + 8 = 17 г/моль.
Пример 3.
Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
1. H2SO4 + 2NaOH = Na2SO4 + 2H2O.
2. 2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O.
3. Al(OH)3 + 3NaCl = AlCl3 + 3NaOH.
4. Zn(OH)2 + NaCl = ZnOHCl + NaOH.
Решение.
Решение. Молярные массы эквивалентов сложных веществ могут иметь различные значения (в зависимости от реакции, в которую они вступают).
Молярная масса эквивалента кислоты (гидроксида) равна ее молекулярной массе, деленной на количество атомов водорода (для гидроксида на количество OH- групп), замещенных в данной реакции другими атомами или ионами.
В первой реакции в молекуле серной кислоты 2 атома водорода замещаются на металл, во второй – 1 атом водорода фосфорной кислоты замещается на металл, поэтому
Мэкв.(H2SO4) =  =
=  ,
,
Мэкв.(H2SO4) = 49 г/моль.
Мэкв.(Н3PO4) = 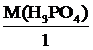 =
=  ,
,
Мэкв.(H3PO4) = 98 г/моль.
Соответственно в 3-й и 4-й реакциях в гидроксидах замещаются на хлорид- ионы три и одна гидроксогруппы соответственно, и их молярные массы эквивалентов равны:
Мэкв.[Al(OH)3] = 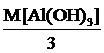 =
=  = 26 г/моль,
= 26 г/моль,
Мэкв.[Zn(OH)2] =  =
=  = 99,4 г/моль.
= 99,4 г/моль.
Пример 4.
На реакцию с 13,61 г дигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции.
Решение.
Молярную массу эквивалента дигидрофосфата калия можно рассчитать по закону эквивалентов:
 =
=  ,
,
Мэкв.(KH2PO4) =  .
.
Молярная масса эквивалента гидроксида калия рассчитывается из соотношения (пример 1.3):
Мэкв.(KOH) =  =
=  = 56,1 г/моль,
= 56,1 г/моль,
Мэкв.(KH2PO4) =  = 136,1 г/моль.
= 136,1 г/моль.
Чтобы написать уравнения реакции, необходимо рассчитать число молей дигидрофосфата калия, вступивших в реакцию. Для этого разделим молекулярную массу дигидрофосфата калия на его молярную массу эквивалента:

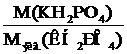 =
= 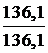 =1 моль.
=1 моль.
Уравнение реакции имеет вид
KH2PO4 + KOH = K2HPO4 + H2O.
Задания
1. Определите эквивалент и молярную массу эквивалента фосфора, кислорода и брома в соединениях PH3, H2O, HBr.
2. Молярная масса эквивалента трехвалентного металла равна 9 г/моль. Вычислите мольную и атомную массу металла, молярную массу эквивалента его оксида и процентное содержание кислорода в оксиде.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента металла. Ответ: 32,5 г/моль.
4. Из 1,35 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалента металла. Ответ: 9 г/моль.
5. Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите молярную массу эквивалента, мольную массу и атомную массу этого элемента.
6. Один оксид марганца содержит 22,56 % кислорода, а другой – 50,50 %. Вычислите молярную массу эквивалента и стехиометрическую валентность марганца в этих оксидах. Составьте формулы оксидов.
7. Выразите в молях: а) 6,02×1022 молекул С2Н2; б) 1,80×1014 атомов N2;
в) 3,01×1023 молекул NH3. Чему равна мольная масса указанных веществ?
8. Вычислите эквивалент и молярную массу эквивалента Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярные массы эквивалента металла и его оксида. Чему равна мольная и атомная масса этого металла?
10. 3,04 г некоторого металла вытесняют 0,252 г водорода, 26,965 г серебра и 15,885 г меди из соединений этих элементов. Вычислите молярные массы эквивалентов указанных металлов. Ответ: 12,16 г/моль, 107,86 г/моль, 63,54 г/моль.
11. Оксид металла содержит 28,57 % кислорода, а его фторид 48,72 % фтора. Вычислите молярные массы эквивалента металла и фтора. Ответ: 20,0 г/моль, 19,0 г/моль.
12. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) дигидроксохлорид; б) гидроксохлорид; в) трихлорид. Вычислите эквивалент и молярную массу эквивалента Fe(OH)3 в каждой из этих реакций.
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) дигидроксонитрата висмута(III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и молярные массы эквивалентов.
14. Вещество содержит 38,0 % серы и мышьяк. Молярная масса эквивалента серы 16,0 г/моль. Вычислите молярную массу эквивалента и стехиометрическую валентность мышьяка, составьте формулу данного сульфида.
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) гидроксодихлорида алюминия. Напишите уравнения реакций этих веществ с НСl и определите их эквиваленты и молярные массы эквивалентов.
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида. Чему равна мольная и атомная масса металла?
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н. у.). Вычислите молярную массу эквивалента, мольную массу и атомную массу металла.
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды. Ответ: 2,0×10–23 г, 3,1×10–27 г.
19. Какой объем при н. у. занимает молярная масса эквивалента кислорода? Вычислите мольную и атомную массу двухвалентного металла, если на окисление 6,34 г этого металла пошло 0,68 л кислорода (н. у.).
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РОз израсходовано 1,291 г КОН. Вычислите эквивалент, молярную массу эквивалента и основность кислоты. Ответ: 0,5 моль, 41 г/моль, 2.
Строение атома
Пример 1.
Определите количество протонов и нейтронов в ядре атома платины.
Решение.
Символ ядра атома обозначается символом соответствующего элемента. Слева вверху над символом указывается массовое число (А), слева внизу - заряд атома (Z), численно равный порядковому номеру элемента.
Согласно современным представлениям, ядро атома состоит из положительно заряженных протонов (p) и не обладающих электрическим зарядом нейтронов (n). Массовое число атома и есть сумма протонов и нейтронов. Число протонов равно порядковому номеру элемента (т. е. его положительному заряду), тогда количество нейтронов находим по разности между массовым числом и порядковым номером элемента: A - Z = N.
Для платины с зарядом ядра 78 число протонов равно 78, а число нейтронов рассчитываем по разности атомной массы и заряда ядра атома:
195 - 78 = 117.  Pt (78 p, 117 n).
Pt (78 p, 117 n).
Пример 2.
При бомбардировке нейтронами изотопов  B и
B и  Mn выделяется a-частица и образуются изотопы
Mn выделяется a-частица и образуются изотопы  Li и
Li и  V. Составьте в полной и сокращенной формах уравнения протекающих ядерных реакций.
V. Составьте в полной и сокращенной формах уравнения протекающих ядерных реакций.
Решение.
При записи уравнения ядерной реакции в левой части пишут вступающие в реакцию ядра, в правой - продукты реакции. При этом следует учитывать законы сохранения заряда и массы частиц. Массы электронов и позитронов не учитываются. Уравнения ядерных реакций:
1.  B +
B +  n =
n =  Li +
Li +  He,
He,
2.  Mn +
Mn +  n =
n =  V +
V +  He.
He.
Суммы массовых чисел и зарядов в левой и правой частях равны:
1. 10 + 1 = 7 + 4, 5 + 0 = 3 + 2,
2. 55 + 1 = 52 + 4, 25 + 0 = 23 + 2.
При сокращенной записи уравнения вначале указывают символ исходного ядра, в скобках пишут бомбардирующую частицу и образующуюся частицу, а за скобками - символ получающегося ядра:
1.  B (n, a)
B (n, a)  Li,
Li,
2.  Mn (n, a)
Mn (n, a)  V.
V.
Пример 3.
Электрон в атоме характеризуется набором квантовых чисел: n = 3, l = 1, m l = 0. Какая форма записи отражает энергетическое состояние электрона?
Решение.
Квантовая химия атомов и молекул состояние каждого электрона описывает волновой функцией y, называемой атомной орбиталью и характеризуемой набором квантовых чисел. Волновая функция y выводится из уравнения Шредингера, а квантовые числа входят в это уравнения в виде целочисленных параметров. Квантовые числа принимают следующие значения:
n = 1, 2, 3, 4, …7;
l = 0, 1,2, 3, … (n - 1);
m l = 0,  1,
1,  2, …
2, …  l;
l;
ms =  1/2.
1/2.
Главное квантовое число n характеризует энергию электрона на энергетическом уровне и размер электронного облака, орбитали. При n = 3 электрон находится на третьем энергетическом уровне. При записи электронной формулы главное квантовое число пишется цифрой.
Орбитальное квантовое число l характеризует энергию электрона на энергетическом подуровне, определяет значение орбитального момента количества движения электрона и форму электронного облака. Орбитальное квантовое число при записи электронной формулы пишется буквой. При l = 0, s-подуровень; l = 1, p-подуровень; l = 2, d-подуровень; l = 3, f-подуровень. Соответственно электроны этих подуровней называются s-, p-, d-, f-электронами. По условию задачи l = 1, это p-электрон.
Магнитное квантовое число m l определяет пространственную ориентацию атомной орбитали в магнитном поле и принимает при данном l – (2 l + 1) значений. s-состоянию (l = 0) отвечает всегда только одна орбиталь; p-состоянию (l = 1) - три орбитали с одинаковой энергией; d-состоянию (l = 2) - пять орбиталей и
f-состоянию (l = 3) - семь орбиталей с одинаковой энергией. В условии задачи
l = 1, этому состоянию отвечают три орбитали: px, py, pz, соответственно координатным осям.
Итак, запись, отражающая энергетическое состояние электрона при n = 3,
l = 1, m l = 0, будет иметь вид 3pz.
Четыре квантовых числа полностью характеризуют состояние электрона в атоме. Они определяют энергию электрона, его размер и форму, спиновой момент количества движения электрона. При переходе электрона с одной орбитали на другую меняются квантовые числа, соответственно меняется состояние электрона в атоме.
Пример 4.
Какой энергетический подуровень заполняется электронами раньше: 5s или 4d; 6s или 5p и почему?
Решение.
Заполнение электронами энергетических уровней и подуровней подчиняется принципу «минимума энергии», т. е. вначале заполняются орбитали с меньшей энергией. Энергетическое состояние электрона характеризуется главным и орбитальным квантовыми числами и заполнение орбиталей происходит в последовательности увеличения их суммы (n + l). Для 5s-орбитали эта сумма равна 5 + 0 = 5, а для 4d-орбитали 4 + 2 = 6. Поэтому 5s- орбиталь заполняется электронами раньше.
Если сумма главного и орбитального квантовых чисел для двух орбиталей одинакова, то раньше заполняется та, у которой меньше значение главного квантового числа. Так, для 6s- и 5d-орбиталей эти суммы одинаковы (6 + 0 = 6 и 5 + 1 = 6), поэтому вначале заполняется 5p-орбиталь, а потом 6s.
Задания
21. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
22. Напишите электронные формулы атомов фосфора и ванадия. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
23. Какое максимальное число электронов может занимать s-, p-, d- и f-орбитали данного энергетического уровня? Почему?
24. Напишите электронные формулы атомов марганца и селена. К какому электронному семейству относится каждый из этих элементов?
25. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р? Почему? Составьте электронную формулу атома элемента с порядковым номером 21.
26. Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 29. У последнего происходит провал одного 4s-электрона на
3d-подуровень. К какому электронному семейству относится каждый из этих элементов?
27. Какие орбитали атома заполняются электронами раньше: 5d или 6s; 7s или 6р? Почему? Составьте электронную формулу атома элемента с порядковым номером 43.
28. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
29. В чем сущность a-, b–- и b+-радиоактивного распада? Изотоп какого элемента получится в результате последовательного излучения 4a- и 2b-частиц с атомным ядром 238U?
30. Составьте электронные формулы атомов элементов с порядковыми номерами 14 и 40. Какие электроны этих атомов являются валентными?
31. Какую радиоактивность называют искусственной? Изотоп какого элемента образуется в результате ядерной реакции, происходящей при бомбардировке ядер атомов 27Аl протонами, если при этом поглощается один протон и выделяется одна a-частица? Составьте уравнение этой ядерной реакции.
32. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 28. К какому электронному семейству относится каждый из этих элементов?
33. Изотоп какого элемента образуется в результате ядерной реакции, происходящей при бомбардировке ядер атомов 54Fe a-частицами, если при этом поглощается одна a-частица и выделяется один нейтрон. Составьте уравнение этой ядерной реакции.
34. Сколько и какие значения может принимать магнитное квантовое число m l при орбитальном квантовом числе l = 0; 1; 2 и 3? Какие элементы в периодической системе носят название s-, р-, d- и f-элементов? Приведите примеры.
35. Какие значения могут принимать квантовые числа n, l, ml и ms, характеризующие состояние электронов в атоме. Какие значения они принимают для внешних электронов атома магния?
36. Чем отличается последовательность в заполнении атомных орбиталей у атомов d-элементов от последовательности заполнения их у атомов s- и
р-элементов? Составьте электронную формулу атома элемента с порядковым номером 46, учитывая, что, находясь в пятом периоде, атомы этого элемента на пятом энергетическом уровне не содержат ни одного электрона.
37. Составьте электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит провал одного 4s-электрона на 3d-подуровень. К какому электронному семейству относится каждый из этих элементов?
38. Значения какого квантового числа определяют число s-, p-, d- и
f-орбиталей на энергетическом уровне? Сколько всего s-, p- и d-электронов в атоме кобальта?
Не нашли, что искали? Воспользуйтесь поиском: