
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторная работа № 3. Домашняя подготовка. Контрольные вопросы
ПРИГОТОВЛЕНИЕ РАСТВОРА
Домашняя подготовка. Контрольные вопросы
1.Какие способы выражения концентрации вы знаете?
Цель работы: Приготовить в мерной колбе объемом 100 мл раствор соляной кислоты заданной концентрации ( 0,10 – 0,20 моль/дм3).
0,10 – 0,20 моль/дм3).
Помните, что
1. С растворами концентрированных кислот работают в вытяжном шкафу.
2. При отборе раствора кислоты пипеткой пользуйтесь грушей.
Перед выполнением работы необходимо ознакомиться с исполь-зуемым оборудованием и правилами работы с ним.
Колбы
Мерные колбы. Мерные колбы служат для приготовления стандартных растворов и для разбавления исследуемых растворов до определенного объема. Это плоскодонные колбы с длинным узким горлом, на котором нанесена круговая метка (рис. 1).

Рисунок 1 – Мерные колбы
Колбы калибруют на содержание в них определенного объема жидкости (на вливание). Объем, указанный на стенке колбы, соответствует объему жидкости (при температуре калибрования), если колба наполнена так, что нижняя часть мениска жидкости касается метки, причем доведение объема жидкости до метки должно осуществляться так, чтобы глаза наблюдателя и метка находились на одном уровне (метка сливается в прямую линию). На горле колбы над меткой не должно быть капель жидкости, внутренние стенки колбы должны быть чистыми, и жидкость должна смачивать их ровным слоем. Закрывают колбы специальными притертыми пробками. Мерные колбы различаются по вместимости: 25; 50; 100; 200; 250; 500 и 1000 мл. Единицей является литр (л) – объем, занимаемый 1 кг воды при 3,98 °С и нормальном атмосферном давлении; тысячная доля литра – миллилитр (мл).
Пипетки
Пипетки применяются для точного отмеривания определенного объема раствора и перенесения его из одного сосуда в другой. Они бывают двух типов: градуированные (измерительные) и мерные, последние, как правило, и применяются в титриметрии (рис. 2).
Мерные пипетки представляют собой узкие трубки с расширением в середине. В верхней узкой части находится круговая метка. Пипетки бывают разной вместимости, обычно 10; 15; 20; 25; 50 мл. Пипетки калиброваны на выливание: если заполнить пипетку до метки и вылить жидкость, ее объем будет соответствовать вместимости, указанной на пипетке, но при этом нужно строго соблюдать нижеследующие правила обращения с пипеткой.

Рисунок 2 – Обычные пипетки:
а – мерная (Мора); б – градуированная; в – серологическая; г – Оствальда-Фолина; д – «ламбда»
Пипетку тщательно моют моющими смесями, заполняя ими пипетку с помощью специального приспособления (пипетатора или шприца), затем ее многократно ополаскивают сначала водопроводной, а затем дистиллированной водой. Убедившись в том, что вода смачивает внутренние стенки ровным слоем, не оставляя капель (в противном случае мытье пипетки повторяют), всю внутреннюю поверхность пипетки ополаскивают 2-3 раза тем раствором, который предполагается отбирать пипеткой.
Для этого раствор наливают в сухой чистый стакан и используют его исключительно для промывания пипетки. Нельзя погружать непромытую пипетку в колбу с исследуемым или стандартным раствором. Ополаскивая пипетку раствором, заполняют ее каждый раз примерно на 1/3 объема, горизонтально вращая, смачивают раствором всю внутреннюю поверхность пипетки.
Затем берут пипетку большим и средним пальцами правой руки, вытирают ее внешнюю часть кусочком фильтровальной бумаги и, погружая ее нижний конец глубоко в раствор, наполняют ее раствором так, чтобы уровень жидкости в ней оказался выше метки примерно на 2 см. После этого быстро зажимают верхнее отверстие пипетки указательным пальцем и, подняв пипетку, удаляют капли раствора с внешней стороны пипетки кусочком фильтровальной бумаги. Затем слегка приоткрывают отверстие, чтобы стекла лишняя жидкость и нижний край мениска коснулся метки (при этом метка должна находиться на уровне глаз). Вновь плотно закрывают отверстие и переносят пипетку в заранее подготовленный сосуд (чаще всего в колбу для титрования). Держа пипетку вертикально, отнимают от ее отверстия палец и дают жидкости свободно вытекать; когда вся жидкость вытечет, прикасаются кончиком пипетки к стенке сосуда и ждут 20 с, пока вытекут остатки (рис. 3).

а б в г
Рисунок 3 – Приемы работы с мерной пипеткой:
а – втяните жидкость выше метки; б – удерживайте уровень жидкости выше метки указательным пальнем; в – слегка наклоните пипетку и вытрите капли снаружи; г – дайте жидкости вытечь из
Порядок работы
1. Приготовление раствора. Разбавленный раствор соляной кислоты готовим из концентрированного раствора с известной плотностью (rр-ра).
По таблице в справочнике определяем процентную концентрацию исходного раствора кислоты и вычисляем объем этого раствора, необходимый для приготовления 100 мл раствора с заданной моль-эквивалентной концентрацией (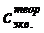 ).
).
Расчеты проводим по следующим формулам:
1) рассчитываем массу HCl, содержащуюся в 100 см3 раствора с концентрацией 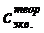 :
:  = …
= …
2) рассчитываем массу исходного раствора с процентной концентрацией w(HCl), содержащую рассчитанную массу HCl:
 …
…
3) рассчитываем объем исходного раствора HCl:
 = …
= …
Вычисленный объем раствора исходной соляной кислоты из бюретки переливаем в мерную колбу вместимостью 100 мл, затем в колбу наливаем дистиллированную воду до половины объема, тщательно взбалтываем, после чего прибавляем воду до метки (нижний край мениска должен касаться метки на горле колбы). Закрываем колбу пробкой и вновь тщательно перемешиваем раствор, перевертывая колбу.
2. Проверка концентрации приготовленного раствора. Бюретку заполняем стандартным раствором NaOH с моль-эквивалентной концентрацией 0,1000 моль/дм3.
Пипетку Мора ополаскиваем приготовленным раствором соляной кислоты (с помощью груши набираем раствор HCl выше метки и выливаем его в сливной стакан). Затем отмеряем пипеткой 10 мл приготовленного раствора HCl (нижний край мениска должен касаться метки) и содержимое пипетки переносим в коническую колбу для титрования. Добавляем 1-2 капли фенолфталеина.
К полученному раствору из бюретки постепенно добавляем стандартный раствор щелочи, при этом непрерывно взбалтываем содержимое колбы. Добавляем раствор NaOH до появления бледно-розовой окраски. Этот момент соответствует полной нейтрализации кислоты щелочью. Описанный прием в аналитической химии называется титрованием.
Титрование повторяем несколько раз до получения трех результатов, отличающихся не более, чем на 0,1 мл. Результаты титрования записываем в таблицу.
Таблица 1 – Объемы раствора щелочи NaOH, необходимые для титрования 10 см3 раствора кислоты HCl
| Объем раствора кислоты, см3 | Средний объем NaOH, см3 | ||
Рассчитываем моль-эквивалентную концентрацию приготовленного раствора соляной кислоты.
Расчет концентрации HCl производим по среднему значению израсходованного объема щелочи, используя формулу:
 (HCl) ´V(HCl) = сэкв(NaOH) ´Vср(NaOH),
(HCl) ´V(HCl) = сэкв(NaOH) ´Vср(NaOH),
где  (HCl) – моль-эквивалентная концентрация соляной кислоты (моль/дм3), которую определяют опытным путем;
(HCl) – моль-эквивалентная концентрация соляной кислоты (моль/дм3), которую определяют опытным путем;
V(HCl) – объем кислоты (в данном случае 10 мл);
сэкв(NaOH) – моль-эквивалентная концентрация стандартного раствора щелочи (титранта, в моль/дм3), равная 0,1000 моль/дм3;
Vср (NaOH) – средний объем раствора щелочи (в мл), пошедший на титрование.
Рассчитываем относительную ошибку, допущенную при приготовлении раствора заданной концентрации
 , ,
|
где 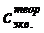 (HCl) – моль-эквивалентная концентрация кислоты, заданная преподавателем;
(HCl) – моль-эквивалентная концентрация кислоты, заданная преподавателем;
 (HCl) – моль-эквивалентная концентрация кислоты, приготовленная вами и найденная титрованием.
(HCl) – моль-эквивалентная концентрация кислоты, приготовленная вами и найденная титрованием.
Делаем вывод.
Не нашли, что искали? Воспользуйтесь поиском: