
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Образец билета контрольной работы
1. До какого объёма надо разбавить 500 мл 20%-ного (по массе) раствора NaCl (r = 1,152 г/мл), чтобы приготовить 4,5%-ный раствор (r = 1,029 г/мл)?
Ответ: до 2,49 л.
2. Чему равны концентрация ионов водорода и pH раствора муравьиной кислоты (HCOOH), если a = 0,03, Ka = 1,8. 10-4?
Ответ: 6. 10-3 моль/л, 2,22.
3. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира температура кипения повысилась на 0,453 K. Определите молекулярную массу растворенного вещества. Е(эфира) = 2,02. Ответ: 145.
4. Определите титр и нормальную концентрацию раствора перманганата калия, если на титрование навески оксалата натрия, равной 0,0165 г, затрачено 20 мл раствора KMnO4.
Ответ: 0,000367 г/мл, 0,0116 моль/л.
ЗАНЯТИЕ 7
Тема: «Элементы химической термодинамики и биоэнергетики. Термохимия».
Тепловые эффекты химических реакций связаны с изменением внутренней энергии системы при переходе от исходных веществ (U1) к продуктам реакции (U2): DU = U2 - U1. Изменение внутренней энергии не зависит от пути перехода, а зависит от начального и конечного состояний системы, определяемых давлением (р), объёмом (V) и температурой (Т):
Q = DU + A (I начало термодинамики)
DU = Q - A; U2 - U1 = Q - A,
где Q – теплота, А – работа расширения. При постоянном давлении А равна р.Dv= p. (v2 - v1), где V1 и V2 - объём системы в исходном (начальном, V1) и конечном состояниях (V2). Т а к и м о б р а з о м:
Qp = (U2 - U1) + p.(V2 - V1) = (U2 + p . V2) - (U1 + p . V1).
Сумму U + p.v называют энтальной и обозначают Н: DH = DU + p . DV.
Тепловой эффект реакции при изобарном процессе Qp равен изменению энтальпии DH: Qp = H2 – H1 = DH
Для изобарного процесса: DH = DHкон - DHисх
Для изохорного процесса тепловой эффект реакции Qv равен изменению внутренней энергии системы: Qv = U2 – U1 = DU.
Для изохорного процесса: DU = DUкон – DUисх.
Термохимические расчеты основаны на законе Гесса и следствиях из него.
Для реакции А  D, DH, протекающей через промежуточные стадии:
D, DH, протекающей через промежуточные стадии:
A  B, DH1
B, DH1
B  C, DH2
C, DH2
C  D, DH3
D, DH3
по закону Гесса: DH = DH1 + DH2 + DH3 или по многоугольнику Гесса (в нашем примере четырехугольнику):
А DH D

DH1 DH3
 B DH2 C
B DH2 C
тепловой эффект прямого превращения или через промежуточные стадии равен:
DH = DH1 + DH2 + DH3. Закон Гесса распространяется не только на химические реакции, но и на все процессы, сопровождающиеся тепловыми эффектами: фазовые превращения, растворение, кристаллизацию, испарение и т.д.
В соответствии со следствиями из закона Гесса для реакции общего вида: aA + bB = cC + dD
DHреак.= SDH¦(прод.) - SDH¦(исх. веществ) =
[c . DH¦(C) + d . DH¦(D)] - [a . DH¦(A) + b . DH¦(B)]
DHреак. = SDHсгор.(исх. веществ) - SDHсгор. (продуктов) =
[a . DHсгор. (A) + b . DHсгор. (B)] - [с . DHсгор. (C) + d . DHсгор. (D)]
Химические реакции протекают как с уменьшением энтальпии (экзотермические реакции, DH < 0), так и с увеличением энтальпии (эндотермические реакции, DH > 0).
Направление, в котором самопроизвольно (т.е. без каких-либо внешних воздействий) протекает химическая реакция, определяется совместным действием двух факторов:
а) энтальпийным, DH < 0
б) энтропийным, DS > 0 (точнее T . DS)
Для вычисления изменения энтропии химической реакции применяют первое следствие из закона Гесса:
DSреакции = DS¦(продуктов) - DS¦(исх. в-в).
О знаке изменения энтропии можно судить по изменению объёма системы:
1) DS > 0, если V2 > V1; т.к.V2 - V1 = DV, то DV > 0.
2) DS < 0, если V2 < V1; т.к. V2 - V1 = DV, то DV < 0
В природе самопроизвольно протекают только те процессы, которые сопровождаются уменьшением энергии Гиббса: DG < 0 при p=const, T = const (DG = G2 – G1).
Самопроизвольный переход системы из начального состояния (G1) в конечное (G2) возможен при условии G1 > G2 (DG < 0). Если G1 = G2, (DG = 0), то система находится в равновесии.
Энергия Гиббса связана с энтальпийным и энтропийным факторами:
DG = DH - T . DS (2ое начало термодинамики).
Для вычисления DG реакции пользуются первым следствием из закона Гесса:
DGреакции = SDG¦(продуктов) - SDG¦(исх. в-в)
Обычно расчеты DH, DS, DG производят при стандартных условиях: р = 101,3 кПа, Т = 298 К.
Способность веществ к химическому взаимодействию называют химическим сродством, мерой химического сродства служит изменение энергии Гиббса. Чем более отрицательна величина DG, тем больше реакционная способность веществ.
Анализ соотношения DG = DН - T . DS показывает, что:
1) если DH < 0 и DS > 0, то DG < 0 - при любых температурах;
2) если DH < 0 и DS < 0, то DG < 0 при достаточных низких температурах, т.е. при |DH| > |T . DS|;
3) если DH > 0 и DS > 0, то DG < 0 при достаточно высоких температурах, т.е. при |T . D S| > |DH|;
4) если DH > 0 и DS < 0, то DG > 0 при любых температурах.
Задачи с решениями.
1. Энтальпии образования NO и NO2 равны соответственно 21,6 и 7,43 ккал/моль. Вычислите тепловой эффект реакции: 2NO + O2 = 2NO2 в кДж.
| Дано: DH¦(NO) = 21,6 ккал/моль | Решение: 1) DНреак. = 2.DH¦(NO2) - 2.DH¦(NO) = |
| D H ¦ (NO2)= 7,43 ккал/моль DHреакции =? 1ккал = 4,18 кДж | 2.7,43 - 2.21,6 = -28,34 (ккал); 2) DHреак.= -28,34 .4,18 = -118,46 (кДж); Ответ: - 118,46 кДж. |
2. Теплоты сгорания ацетилена и этана равны соответственно -1300 и -1540 кДж/моль. Чему равна теплота гидрирования ацетилена до этана?
| Дано: DHсгор.(C2H2) = -1300кДж/моль D Hсгор . (C2H6)= -1540кДж/моль DHреакции =? | Решение: C2H2 + 2H2 = C2H6 DHсгор.(H2) = DHобр.(H2O) = -286 (кДж/моль) |
DHреакции = [DHсгор.(C2H2) + 2 . DHсгор.(H2)] - DHсгор.(C2H6) =
-1300 - 2 . 286 + 1540 = -332 (кДж)
Ответ: - 332 кДж.
3. Вычислите теплоту образования кристаллогидрата СaCl2 . 6H2O из безводной соли (теплоту гидратации) по следующим данным: теплота растворения CaCl2 . 6H2O равна +18,02 кДж/моль, теплота растворения CaCl2 равна -72,9 кДж/моль.
Решение: 1) составим треугольник Гесса:
CaCl2 . 6H2O
 | |||
 | |||
DHгидрат. DHрастворения (CaCl2 . 6H2O)
 CaCl2, H2O CaCl2
CaCl2, H2O CaCl2
DHрастворения (CaCl2)
2) По треугольнику Гесса:
DHрастворения (CaCl2) = DHгидр. + DHрастворения (CaCl2 . 6H2O)
DHгидр. = DНрастворения (CaCl2) - DHрастворения (CaCl2 . 6H2O) =
-72,9 - 18,02 = -90,92 (кДж/моль). Ответ: - 90,92 кДж/моль.
4. Рассчитайте изменение энергии Гиббса для процесса окисления глюкозы C6H12O6(к) + 6O2(г) = 6СО2(г) + 6Н2О(ж) при температуре 37°, если DНсгор.(С6Н12О6)= - 2801 кДж/моль, а энтропии веществ равны (в Дж/моль . K): S(C6H12O6) = 210, S(O2) = 205, S(CO2) = 213, S (H2O) = 70.
Решение:

 1) DSреакции = SS f (продуктов) − SS f (исх. в-в) = [6 . Sf(CO2) + 6 . S f (H2O)] - [S f (C6H12O6) + 6 . S f (O2)] = 6 . 213 + 6 . 70 - (210 + 6 . 205) = 58 (Дж/моль . K)
1) DSреакции = SS f (продуктов) − SS f (исх. в-в) = [6 . Sf(CO2) + 6 . S f (H2O)] - [S f (C6H12O6) + 6 . S f (O2)] = 6 . 213 + 6 . 70 - (210 + 6 . 205) = 58 (Дж/моль . K)
2) DG = DH - T . DS = -2801 - 310 . 258 . 10-3 = -2881(кДж/моль)
3) DG << 0, что свидетельствует о самопроизвольном протекании процесса окисления глюкозы в организме. DH < 0 (экзотермическая реакция), DS > 0, т.е. и энтальпийный, и энтропийный факторы способствуют протеканию реакции.
5. При некоторой температуре Т эндотермическая реакция А  В практически идёт до конца. Определите: а) знак DSреакции; б) знак DGреакции В
В практически идёт до конца. Определите: а) знак DSреакции; б) знак DGреакции В  А при температуре Т; в) возможность протекания реакции В
А при температуре Т; в) возможность протекания реакции В  А при низких температурах.
А при низких температурах.
Решение:
а) DG < 0 для реакции А  В, поэтому при DH > 0 для этой реакции, DS > 0, что следует из соотношения DG = DH - T . DS;
В, поэтому при DH > 0 для этой реакции, DS > 0, что следует из соотношения DG = DH - T . DS;
б) DG > 0 для реакции В  А, DH < 0 и DS < 0;
А, DH < 0 и DS < 0;
в) реакция В  А возможна, при низких температурах T . DS мало и DH > T . DS (по абсолютной величине), поэтому DG < 0.
А возможна, при низких температурах T . DS мало и DH > T . DS (по абсолютной величине), поэтому DG < 0.
Вопросы и задачи для самоподготовки.
1. Что называют системой в химической термодинамике? Какова классификация систем?
2. Какие условия состояния системы называются стандартными?
3. Что называют функцией состояния системы? Перечислите функции состояния.
4. Какую энергию называют внутренней энергией системы (U)?
5. Какова формулировка I начала термодинамики? Запишите математическое выражение этого закона.
6. При каких условиях изменение внутренней энергии (DU) равно теплоте, получаемой системой из окружающей среды?
7. Какой процесс называют изобарным? На что затрачивается теплота, получаемая системой в условиях постоянного давления?
8. К какому изменению внутренней энергии проявляет стремление каждая система? В чём это находит выражение?
9. Каким уравнением определяется энтальпия и её изменение?
10. При каких условиях изменение энтальпии (DH) равно теплоте, получаемой системой из окружающей среды?
11. Какой закон является основным законом термохимии? Кто автор? Дайте формулировку.
12. Что называется тепловым эффектом химической реакции? Какие уравнения называются термохимическими?
13. Что называют теплотой: а) образования; б) сгорания веществ? В каких единицах их выражают?
14. Перечислите следствия, вытекающие из закона Гесса. Для каких определений они используются в термохимических расчётах?
15. В изолированных системах все самопроизвольные процессы протекают в сторону увеличения беспорядка. Как изменяется при этом энтропия?
16. Какую тенденцию системы выражает: а) энтальпийный; б) энтропийный фактор?
17. Какая функция состояния системы даёт количественную характеристику одновременного влияния энтальпийного и энтропийного факторов? Каким уравнением это выражается?
19. Какую энергию называют энергией Гиббса (свободной энергией, изобарно-изотермическим потенциалом)?
19. Каким образом изменение энергии Гиббса (DG) указывает на тер-модинамическую возможность или невозможность самопроизвольного протекания процесса? Какое значение DG определяет равновесное состояние системы?
20. При каком соотношении DH и T . DS: а) система находится в равновесии; б) химический процесс направлен в сторону экзо- или эндотермической реакции?
21. Чем объясняется возможность эндотермических реакций и почему она возрастает с увеличением температуры?
22. Энтальпийным или энтропийным фактором определяется направление химической реакции при очень низких температурах?
23. При каких значениях по знаку DH и T . DS в системе возможны только экзотермические процессы?
24. Вычислите значение DHреакции превращения глюкозы в организме:
а) C6H12O6(к) = 2C2H5OH(ж) + 2СO2(г)
б) C6H12O6(к) + 6O2(г) = 6СО2(г) + 6 Н2О(ж)
Какая из этих реакций поставляет организму больше энергии?
DH¦(C6H12O6 (к)) = -1273 кДж/моль, DH¦(C2H5OH) = -278 кДж/моль
DH¦(CO2 (г)) = -393 кДж/моль, DH¦(H2O(ж) ) = -286 кДж/моль
Ответ: а) -69 кДж; б) -2801 кДж.
25. Теплоты сгорания углеводов, белков и жиров в организме человека составляют соответственно 4,6; 4,2; 9,3 ккал/г. Среднесуточная потребность в углеводах, белках и жирах для студентов - мужчин составляет 451, 113 и 106 г, для студентов - женщин 383, 96 и 90 г. Какова суточная потребность студентов в энергии? Ответ: 3535 ккал и 3002 ккал.
26. Теплоты образования Н2О (ж) и Н2О (г) равны соответственно -286 и -242 кДж/моль. Определите теплоту испарения воды. Сколько теплоты будет потеряно при выделении через кожу 750 г воды?
Ответ: 44 кДж/моль; 1833 кДж.
27. Почему процесс денатурации белка трипсина при 50° является са-мопроизвольным, хотя реакция является эндотермической, тепловой эффект равен 2725,7 кДж/моль, S реакции равен 8,8 кДж/моль . K?
Ответ: DGреакции = -116,3 кДж.
28. При взаимодействии 3,6 г оксида железа (II) с оксидом углерода (II) выделяется 0,71 кдж, а при сгорании 2,8 г оксида углерода (II) выделяется 28,29 кДж теплоты. Вычислите стандартную энтальпию образования твёрдого оксида железа (II). Ответ: -268,7 кДж/моль.
29. При сгорании 2 моль фосфина РН3 образуется оксид фосфора (V), вода и выделяется 2440 кДж теплоты. Определите стандартную энтальпию образования фосфина, если стандартные энтальпии образования оксида фосфора (V) и воды равны соответственно -1528 и -286 кДж/моль. Ответ: 27 кДж/моль.
30. Найдите энтальпию сгорания алмаза, если стандартная энтальпия сгорания графита равна -393,51 кДж/моль, а энтальпия фазового перехода С(графит) ® С(алмаз) составляет 1,88 кДж/моль. Ответ: -395,39 кДж/моль.
31. Вычислите энтальпию гидратации карбоната натрия, если энтальпия растворения безводной соли -25,08 кДж/моль, энтальпия растворения десятиводного кристаллогидрата 66,88 кДж/моль. Ответ: -91,96 кДж/моль.
32. Определите знаки DH0, DS0 и DG0 для реакции АВ(кр)+В2(г) = АВ3(к), протекающей при 298 K в прямом направлении. Будет ли DG0 возрастать или убывать с ростом температуры.
Ответ: DS0 < 0; DG0 < 0; DH0 < 0; DG0 с ростом температуры возрастает.
33. Пользуясь значениями DH0¦, S0¦ и DG0¦ отдельных соединений, вычислите двумя способами 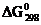 реакции COCl2 = CO + Cl2.
реакции COCl2 = CO + Cl2.
DH0¦, кДж/моль -223 -110,5 0
S0¦, Дж/(моль . K) 289,2 197,4 223
DG0¦, кДж/моль -210,4 -137,2 0
и определите возможность её осуществления в стандартных условиях.
Ответ: 73,2 кДж; DG0 > 0 и реакция в данных условиях неосуществима.
34. Вычислите DH0, DS0 и DG0 (при 298 K) для реакции
2Ag(тв) + Hg2Cl2(тв) ® 2AgCl(тв) + 2 Hg(ж), если
DH0¦, кДж/моль 0 -264,9 -127,03 0
S0¦, Дж/(моль . K) 42,7 196 96,11 77,4
DG0¦, кДж/моль 0 -210,7 -109,72 0
Покажите, что для этой реакции выполняется соотношение DG=DН - T . DS. Протекает ли самопроизвольно эта реакция? Благоприятствует ли изменение энтальпии и энтропии (в отдельности) самопроизвольному протеканию этой реакции или наоборот?
Ответ: -8,74 кДж; 10,84 кДж; 65,62 Дж/K; реакция должна протекать самопроизвольно; протеканию реакции благоприятствует лишь энтропийный фактор.
Не нашли, что искали? Воспользуйтесь поиском: