
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Образец билета тестированного контроля
по теме: Химическая термодинамика и термохимия.
Вопросы: Ответы:
1. К каким химическим процессам применим а) изобарным;
закон Гесса? б) изотермическим;
в) изобарно-изотермическим.
2. Укажите правильное соотношение DH для а) DH2 < DH1 < DH3
(1) H2(г) + O(г) = H2O(г) б) DH2 > DH1 > DH3
(2) H2(г) + 0,5 O2(г) = H2O(г) в) DH1 > DH2 > DH3
(3) 2H(г) + O(г) = H2O(г)
| 3. В каком случае энтальпия реакции нейтрализации составляет -56,5 кДж/моль? а) при нейтрализации слабой кислоты сильным основанием; б) при нейтрализации слабой кислоты слабым основанием; в) при нейтрализации сильной кислоты сильным основанием. 4. Вычислите энтальпию реакции: CuS(тв) + 2O2(г) = CuSO4(тв), если DH f (CuS) = -48,5 кДж/моль; DH f (CuSO4) = -769,12 кДж/моль. а) -817,62 кДж; б) -720,62 кДж; в) 720,62 кДж. 5. Вычислите энтальпию фазового перехода Sаморф. ® Sкрист., если DHсгор. (Sкрист.) = -849,8 кДж/моль; DHсгор.(Sаморф.) = -866,5кДж/моль. а) 16,7 кДж; б) -16,7 кДж; в) 1716,3 кДж. 6. В каком из следующих случаев реакция возможна при любых температурах? а) DH < 0; DS > 0; б) DH > 0; DS > 0; в) DH < 0; DS < 0. |
Ответы на задания образца билета ТК:
| Номер вопроса | ||||||
| Код ответа | в | б | в | б | б | а |
ЗАНЯТИЕ 8.
Тема: Химическая кинетика и катализ.
Под скоростью химической реакции понимают изменение концентрации одного из участников реакции в единицу времени при неизменном объёме системы. При этом не важно о каком из участвующих в реакции веществ идет речь, так как все они связаны между собой уравнением реакции, а потому по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентрации всех остальных. Концентрацию (С) выражают в
моль/л, а время (t) в секундах или минутах.
Средняя скорость реакции А + В = С + D равна 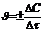 , где DC = C2 - C1, Dt = t2 - t1.
, где DC = C2 - C1, Dt = t2 - t1.
Знак минус ставится потому, что, несмотря на убывание концентрации одного из реагирующих веществ А или В и, следовательно, на отрицательное значение разности С2 - С1, С2 < С1, DС < О, скорость реакции может быть только положительной величиной. Если же следить за изменением концентрации одного из продуктов реакции С или D, то она в ходе реакции будет возрастать С2 > С1, DС > О, и поэтому в правой части приведенного уравнения надо ставить знак плюс.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ (закон действующих масс):
u = k  C(A)
C(A)  C(B), где
C(B), где
С(А) и С(В) - молярные концентрации А и В, k - константа скорости реакции зависит от природы веществ и от температуры.
Для гомогенной реакции общего вида: а А + в В = с С + d D
u = k  Ca(A)
Ca(A)  Cb(B)
Cb(B)
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называют кинетическим уравнением реакции.
Для гетерогенной реакции вида: 1) А(г) + 2В(тв) = АВ2 (ж)
u = k . С(А)
2) А(г)+ 2В(ж) = АВ2 (ж)
u = k . С(А)
3) А(ж) + 2В(тв) = АВ2 (ж)
u = k . С (А)
Таким образом, в кинетическое уравнение не входит концентрация твёрдого вещества (всегда), а жидкого - в реакции с газом.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, которое математически выражается соотношением: 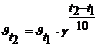 , где
, где
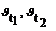 - скорость реакции соответственно при начальной и конечной темпе-ратурах; g - температурный коэффициент, который показывает во сколько раз увеличилась константа скорости реакции при увеличении температуры на 100.
- скорость реакции соответственно при начальной и конечной темпе-ратурах; g - температурный коэффициент, который показывает во сколько раз увеличилась константа скорости реакции при увеличении температуры на 100.
Правило Вант-Гоффа является приближенным, более точно зависимость скорости от температуры выражается уравнением Аррениуса:
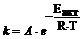 , где
, где
A - постоянная, независящая от температуры; e = 2,17828 (основание натураль-ного логарифма); Eакт - энергия активации; R = 8,314 Дж/моль . K (газовая постоянная); T - абсолютная температура (Т = t + 273).
Задачи с решениями
1. Гомогенная реакция между веществами А и В протекает по уравнению 2А + В = С, концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2  моль-2
моль-2  с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
Решение:
Согласно закону действующих масс: u = k  C2(A)
C2(A)  C(B). Скорость химической реакции в начальный момент равна u0 = 0,5
C(B). Скорость химической реакции в начальный момент равна u0 = 0,5  62
62  5 = 90,0 (моль
5 = 90,0 (моль  л-1
л-1  с-1). По истечении некоторого времени в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет равной С1(В) = 0,45
с-1). По истечении некоторого времени в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет равной С1(В) = 0,45  5 = 2,25 (моль/л).
5 = 2,25 (моль/л).
Значит, концентрация вещества В уменьшилась на 5,0 - 2,25 = 2,75 (моль/л).
Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль/л (2,75  2) и стала равной 6,0 - 5,5 = 0,5 (моль/л).
2) и стала равной 6,0 - 5,5 = 0,5 (моль/л).
Скорость химической реакции в тот момент, когда в реакционной смеси останется 45% вещества В, станет u1 = 0,5  (0,5)2
(0,5)2  2,25 = 0,28 (моль
2,25 = 0,28 (моль  л-1
л-1  с-1).
с-1).
Ответ: u0 = 90,0 моль/(л . с), u1 = 0,28 моль/(л . с).
2. Окисление глюкозы в организме протекает через несколько промежуточных стадий по суммарному уравнению: С6Н12О6 (т) + 6О2 (г) = 6СО2 (г) + Н2О(ж). Запишите кинетическое уравнение этой реакции и определите, как изменится скорость реакции: а) в условиях высокогорья, где концентрация кислорода вдвое меньше; б) в барокамере, где давление воздуха вдвое больше атмосферного.
Решение:
Запишем кинетическое уравнение реакции окисления глюкозы:
u = k  C6(O2)
C6(O2)
Обозначим начальную концентрацию О2 через а моль/л, тогда
u0 = k  а 6
а 6
а) В условиях высокогорья С1(О2) = а /2 моль/л. u1 = k  (а /2)6 =
(а /2)6 =  . Определим как изменяется скорость:
. Определим как изменяется скорость: 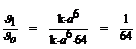 .
.
Следовательно, скорость реакции уменьшается в 64 раза.
б) В барокамере С(О2) = 2 а моль/л. u2 = k  (2 а)6 = 64.k
(2 а)6 = 64.k  а 6. Определим, как изменится скорость:
а 6. Определим, как изменится скорость: 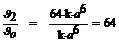 .
.
Следовательно, скорость реакции увеличивается в 64 раза.
3. Во сколько раз уменьшится скорость окисления глюкозы в организме, если уменьшить температуру тела с 37° до 30° при температурном коэффициенте g = 1,7?
Решение:
По правилу Вант-Гоффа: 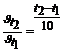 ,
, 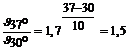 .
.
Следовательно, скорость реакции уменьшилась в 1,5 раза.
4. При увеличении температуры от 10° до 50°С скорость реакции увеличилась в 16 раз. Определите её температурный коэффициент.
Решение:
По правилу Вант-Гоффа:
 , g4 = 16; g =
, g4 = 16; g = 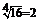
Ответ: температурный коэффициент реакции равен 2.
5. Раствор лекарственного вещества содержит 500 активных единиц в 1мл. Через 40 дней в нём осталось 20 единиц в мл. Реакция протекает по первому порядку. Рассчитайте константу скорости и период полупревращения реакции.
Решение:
Для реакции 1-го порядка
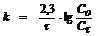 ,где
,где
С0 и Сt - начальная и текущая концентрации, а t - время.
t = 24 . 40 (дней) = 960 (часов).
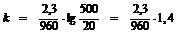 = 0,0034 (час-1)
= 0,0034 (час-1)
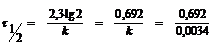 = 203,5 (час) = 8,5 (дней).
= 203,5 (час) = 8,5 (дней).
6. В ферментативной реакции через час после её начала осталось 48 г субстрата, а через 3 часа - 27 г. Определите начальную концентрацию субстрата, считая, что реакция имеет первый порядок.
Решение: Для реакции 1-го порядка: 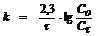
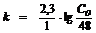 ;
; 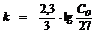 ;
; 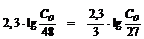
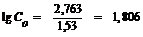 ; С0 = 63,97 г субстрата.
; С0 = 63,97 г субстрата.
7. Как изменится скорость реакции: 4HCl + O2 ® 2Cl2 + 2H2O, протекающей в газовой фазе, если увеличить в три раза:
1) концентрацию кислорода;
2) концентрацию хлороводорода;
3) давление в системе?
Решение: Если обозначить концентрации HCl и O2 соответственно через x и y, то выражение для скорости реакции примет вид: u = k . C4(HCl) . C(O2) = k 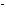 x 4
x 4 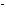 y. После увеличения концентрации в 3 раза они будут равны 3 x для HCl и 3 y для O2, поэтому:
y. После увеличения концентрации в 3 раза они будут равны 3 x для HCl и 3 y для O2, поэтому:
1) u = k  x 4
x 4  3 y = 3k
3 y = 3k  x 4
x 4  y. Увеличение скорости реакции по отношению к первоначальной составляет:
y. Увеличение скорости реакции по отношению к первоначальной составляет: 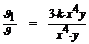 = 3.
= 3.
2) u = k 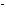 (3 x)4
(3 x)4 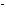 y = 81
y = 81 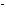 k
k 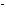 x 4
x 4 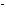 y, u2/u = 81.
y, u2/u = 81.
3) Увеличение давления во столько же раз увеличивает концентрацию газообразных реагирующих веществ, поэтому: u3 = k 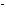 (3 x)4
(3 x)4 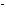 3
3 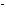 y = 243k
y = 243k 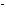 x 4
x 4 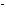 y, u3/u = 243.
y, u3/u = 243.
Вопросы и задачи для самоподготовки.
1.Что изучает химическая кинетика? Какова ее практическая цель?
2. Что называется скоростью химической реакции, какова её размерность?
3. Дайте определения и приведите примеры гомогенных и гетерогенных реакций. Как находятся их скорости?
4. В каких случаях правая часть равенства u = DC/Dt имеет знак «+» или «-»? Как называется величина u?
5. От каких факторов зависит скорость химических реакций? Сформулируйте закон действующих масс.
6. Что называют константой скорости? Каков физический смысл этой величины? Зависит ли константа скорости от температуры, природы реагирующих веществ и их концентрации?
7. Изменится ли значение константы скорости реакции: а) при замене одного катализатора другим; б) при изменении концентрации реагирующих веществ?
8. Что такое молекулярность реакции; порядок реакции? Приведите примеры моно-, ди- и тримолекулярных реакций; реакций нулевого, первого, второго, третьего порядков.
9. Напишите кинетические уравнения следующих химических реакций:
а) H2 (г) + Cl2 (г) ® 2 HCl (г)
б) 2 NO (г) + O2 (г) ® 2 NO2(г)
в) CaO(т) + CO2(г)® CaCO3(г)
г) 4NH3(г) + 3 О2(г) ® 2 N2(г) + 6H2O(г)
д) FeO(т) + H2(г) ® Fe(т) + H2O(ж)
10. Как влияет давление на скорость реакции?
11. Какими формулами выражаются правило Вант-Гоффа, уравнение Аррениуса, определяющие зависимость скорости реакции от температуры?
12. Что называют температурным коэффициентом скорости реакции? Какие он может иметь значения?
13. Почему повышение температуры увеличивает скорость реакции? Какие молекулы называют активными?
14. Зависит ли температурный коэффициент скорости реакции от значения энергии активации?
14. Зависит ли значение энергии активации реакции в случае гетерогенного
катализа от площади поверхности катализатора и от её структуры?
16. Скорость каких реакций в большей степени зависит от температуры - тех, у которых энергия активации небольшая или наоборот?
17. В каком случае скорость одной и той же реакции в большей степени зависит от температуры: при проведении её с катализатором или без катализатора?
18. Что такое активированный комплекс, энергия активации? Изобразите энергетическую диаграмму реакции, идущей с образованием активированного комплекса.
19. Сущность катализа. Механизм гомогенного и гетерогенного катализа. Понятие о ферментативном катализе.
20. При взаимодействии SO2 и O2 концентрация последнего уменьшилась за 1 час на 0,25 моль/л. Как изменится при этом концентрация SO2 и чему равна средняя скорость реакции?
Ответ: уменьшится на 0,5 моль/л; 8,33 . 10−3 моль/л  с.
с.
21. При синтезе аммиака к данному моменту времени прореагировало 0,9 моль/л водорода, а его начальная концентрация равна 1,4 моль/л. Определите концентрацию оставшегося водорода и прореагировавшего азота.
Ответ: 0,5 и 0,3 моль/л.
22. Найдите константу скорости реакции 2А + В ® С, зная, что при концентрациях А и В, соответственно равных 0,5 и 0,6 моль/л, её скорость составляет 0,018 моль/(л  мин). Ответ: 0,12 л2/моль2
мин). Ответ: 0,12 л2/моль2  мин.
мин.
23. Гомогенная реакция идет по уравнению А + 2В ® С; константа её скорости при данной температуре равна 0,4 л2/моль2  с, а начальные концентрации составляют: 0,3 моль/л вещества А и 0,5 моль/л вещества В. Вычислите скорость этой реакции при той же температуре в начальный момент и после того, как прореагирует 0,1 моль/л вещества А. Ответ: 0,03 и 0,0072 моль/л
с, а начальные концентрации составляют: 0,3 моль/л вещества А и 0,5 моль/л вещества В. Вычислите скорость этой реакции при той же температуре в начальный момент и после того, как прореагирует 0,1 моль/л вещества А. Ответ: 0,03 и 0,0072 моль/л  с.
с.
24. Для того, чтобы увеличить в 216 и 256 раз скорость реакции синтеза NH3, во сколько раз надо повысить в первом случае концентрацию H2, а во втором - давление? Ответ: увеличить в 6 и 4 раза.
25. Температурный коэффициент реакции равен 2,5. Как изменится её скорость: а) при повышении температуры от 800 до 1400С; б) при охлаждении реакционной смеси от 500 до 300С.
Ответ: а) увеличится в 244; б) уменьшится в 6,25 раза.
26. При 1500С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитайте, через какое время закончится эта реакция, если проводить её: а) при 2000С; б) при 800С? Ответ: а) 9,8 с; б) 162,77 час.
27. Во сколько раз увеличится скорость реакции, протекающей при 298 K, если энергию активации её уменьшить на 4 кДж/моль? Ответ: в 5 раз.
Не нашли, что искали? Воспользуйтесь поиском: