
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Список рекомендованной литературы
1. Князев, Д. А. Неорганическая химия: учебник для бакалавров / Д. А. Князев, С. Н. Смарыгин. – 4-е изд. – Москва: Юрайт, 2012. – 587 с.
2. Коровин Н. В. Общая химия. М.: Высшая школа, 2007. 557 с.
3. Угай Я.А. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, 2002.
4.Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. М.: Химия. 2000. 480 с.

Приложение 2
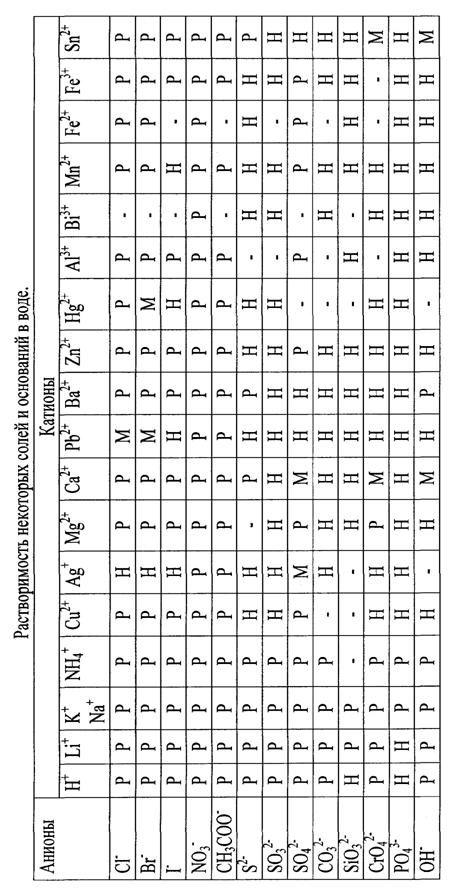
Приложение 3
Формулы кислот и названия их анионов
| Формула | Анион | Название аниона | |
| международное | русское | ||
| HF HCl HBr HI H2S H2S HNO2 HNO3 CH3COOH HMnO4 H2SO4 H2SO4 H2SO3 H2SO3 H2CO3 H2CO3 H2SiO3 H3PO4 H3PO4 H3PO4 HClO HClO2 HClO3 HClO4 H2CrO4 H2Cr2O7 | F¯ Cl¯ Br¯ I¯ S2- HS¯ NO2¯ NO3¯ CH3COO¯ MnO4¯ SO42- HSO4¯ SO32- HSO3¯ CO32- HCO3¯ SiO32- PO43- HPO42- H2PO4¯ ClO¯ ClO2¯ ClO3¯ ClO4¯ CrO42- Cr2O72- | фторид хлорид бромид иодид сульфид гидросульфид нитрит нитрат ацетат перманганат сульфат гидросульфат сульфит гидросульфит карбонат гидрокарбонат метасиликат фосфат гидрофосфат дигидрофосфат гипохлорит хлорит хлорат перхлорат хромат дихромат | фтористый хлористый бромистый йодистый сернистый кислый сернистый азотистокислый азотнокислый уксуснокислый марганцевокислый сернокислый кислый сернокислый сернистокислый кислый сернистокислый углекислый кислый углекислый метакремниевокислый фосфорнокислый кислый фосфорнокислый двухзамещенный кислый фосфорнокислый однозамещенный хлорноватистокислый хлористокислый хлорноватокислый хлорнокислый хромовокислый двухромовокислый |
Приложение 4
Амфотерные оксиды и соответствующие им кислоты, основания
| Амфотерный оксид | Основание | Соответствующий гидрооксид | |
| кислота | название кислоты | ||
| ZnO BeO SnO SnO2 PbO PbO2 Al2O3 Al2O3 Cr2O3 Cr2O3 | Zn(OH)2 Be(OH)2 Sn(OH)2 Sn(OH)4 Pb(OH)2 Pb(OH)4 Al(OH)3 Al(OH)3 Cr(OH)3 Cr(OH)3 | H2ZnO2 H2BeO2 H2SnO2 H2SnO3 H2PbO2 H2PbO3 HAlO2 H3AlO3 HCrO2 H3CrO3 | цинковая бериллиевая оловянистая оловянная свинцовистая свинцовая метаалюминиевая ортоалюминиевая метахромистая ортохромистая |
Приложение 5
Таблица 14. Стандартные энтальпии образования ΔНo298 некоторых веществ
| Вещество | Агрегатное состояние | ΔНo298, кДж/моль |
| CS2 | Г | + 115,28 |
| NO | Г | + 90,37 |
| C6H6 | Г | + 82,93 |
| H2S | Г | - 20,15 |
| NH3 | Г | - 46,19 |
| CH4 | Г | - 74,85 |
| C2H6 | Г | - 84,67 |
| HCl | Г | - 92,31 |
| CO | Г | - 110,52 |
| C2H5OH | Г | - 235,31 |
| H2O | Г | - 241,83 |
| H2O | Ж | - 285,84 |
| NH4Cl | К | - 315,39 |
| CO2 | Г | - 393,51 |
Стандартные абсолютные энтропии So298 некоторых веществ
| Вещество | Состояние | So298, Дж/моль∙град | Вещество | Состояние | So298, Дж/моль∙град |
| С | Алмаз | 2,44 | N2 | Г | 191,49 |
| С | Графит | 5,69 | NH3 | Г | 192,50 |
| S | Ромбич. | 31,90 | CO | Г | 197,91 |
| H2O | Ж | 69,94 | C2H2 | Г | 200,82 |
| H2 | Г | 130,59 | O2 | Г | 205,03 |
| CH4 | Г | 186,19 | H2S | Г | 205,64 |
| HCl | Г | 186,68 | NO | Г | 210,20 |
| H2O | Г | 188,72 | CO2 | Г | 213,65 |
| Cl2 | Г | 222,95 |
Приложение 6

Приложение 7
Наиболее часто встречающиеся в ОВ реакциях элементы и их соеди-нения имеют следующие степени окисления:
Н -1 0 +1
Гидриды металлов(СаН2 Н2 Н2О, ОН ¯
N -3 –2 – 1 0 +1 +2 +3 +4 +5
NH3 N2H4 NH2OH N2 N2O NO N2O3 NO2 N2O NH4+ NO2¯ NO3¯
O -2 –1 0 +2
Н2О, ОН ¯ H2O2 O2, O3 OF2
P -3 0 +1 +3 +5
PН3 P4 PO2 H2¯ PO3 H 2- PO4 3-
PH4+
As -3 0 +3 +5
AsН3 As AsO33- AsO43-
S –2 0 +2 +4 +6
S2- S8 SO SO2 SO3
S2O32-, [Sn] 2- SO32- SO42-, S2O32-
CI (Br,I) -1 0 +1 +3 +5 +7
CI¯ CI2 CIO¯ CIO2¯ CIO3¯ CIO4¯
Fe 0 +2 +3 +6
Fe Fe2+ Fe3+ FeO42-
Fe(OH)2 Fe(OH)3
FeO2¯
Mn 0 +2 +4 + 6 +7
Mn Mn2+ MnO2 MnO42- MnO4¯
Cr 0 +2 +3 + 6
Cr Cr2+ Cr3+ Cr2O72- (в кислой среде)
Cr (OH)2 [Cr (OH)6] 3- CrO42- (в щелочной среде)
Sn 0 +2 +4
Sn Sn2+ Sn4+ (в кислой среде)
[Sn (OH)4] 2- [Sn (OH)6] 2- (в щелочной среде)
(аналогично для свинца)
Bi 0 +3 + 5
Bi Bi3+ BiO3¯
Не нашли, что искали? Воспользуйтесь поиском: