
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
ХИМИЯ
Методические указания
для самостоятельной работы студентов
очной и заочной форм обучения
Часть 2
Факультеты: ИСФ, ЭЭФ, ФПМ и ИТ, ФЭ
Для всех направлений бакалавриата
Вологда
УДК 620.1
Химия: Методические указания для самостоятельной работы студентов очной и заочной форм обучения. Часть 2. – Вологда: ВоГТУ, 2012, - 36 с.
Вторая часть методических указаний включает в себя контрольные вопросы и задачи по основным модулям курса общей химии 2 части программы. В каждом модуле предлагается 25 задач различной степени сложности. В конце методических указаний приведена таблица с вариантами выполнения работ для студентов-заочников.
Утверждено редакционно-издательским советом ВоГТУ
Составители: Тихановская Г.А., канд. биол. наук, доцент
Воропай Л.М., канд. хим. наук, доцент
Мальцева С.Б., канд. техн. наук, доцент
Фокичева Е.А., канд. техн. Наук, доцент
Ерехинская О.П., ассистент
Рецензент: Лебедева Е.А. канд. техн. наук, доцент кафедры ВиВ
Вологодского государственного технического университета
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
II часть методических указаний для студентов очной и заочной форм обучения включает следующие обязательные модуля курса общей химии: окислительно-восстановительные процессы; гальванический элемент; процессы электролиза; коррозия металлов; комплексные соединения; химия элементов s, р, d-семейства; химия органических соединений.
В каждом модуле предлагается 25 задач различной степени сложности, которые рекомендуется прорешать на выбор всем студентам.
Последняя задача в контрольной работе для студентов заочников различных специальностей дается по выбору преподавателя в соответствии с профессиональной подготовкой будущих специалистов.
Поэтому в методических указаниях представлено несколько задач под одинаковыми номерами (225-250).
В конце указаний приведена таблица с вариантами выполнения контрольных работ для студентов-заочников.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
1. Закончить уравнения реакций и расставить коэффициенты. В каком направлении протекает реакция?
Cu2S + HNO3  Cu(NO3)2 + H2SO4 + NO2 +...
Cu(NO3)2 + H2SO4 + NO2 +...
2. Закончить уравнения реакций и расставить коэффициенты. В каком направлении протекает реакция?
As2S3 + HNO3 + H2O  H3AsO4 + H2SO4 + NO.
H3AsO4 + H2SO4 + NO.
3. Может ли перманганат калия окислить в кислой среде производные Сr (III) до Cr (VI)? Покажите на примере.
4. Может ли концентрированная азотная кислота окислить свинец до PbO2; олово - до SnO2? Приведите примеры.
5. Можно ли использовать PbO2 в качестве окислителя для осуществления в стандартных условиях реакций:
а) Mn2+ + 4H2O – 5e = MnO  + 8H+;
+ 8H+;
б) 2Cr3+ + 7H2O – 6e = Cr2O  + 14H+.
+ 14H+.
6. В каком направлении при стандартных условиях протекают реакции:
а) P2S3 + HNO3 конц .(+H2O?)  H3PO4 + H2SO4 + NO;
H3PO4 + H2SO4 + NO;
б) P2S5 + HNO3 конц .(+H2O?)  H3PO4 + H2SO4 + NO2.
H3PO4 + H2SO4 + NO2.
7. В каком направлении при стандартных условиях протекают реакции:
а) NH4HS + HNO3 конц., изб.  N2 + H2SO4 + NO;
N2 + H2SO4 + NO;
б) FeSO4 + HNO3  Fe(NO3)3 + NO2 + H2SO4 + H2O.
Fe(NO3)3 + NO2 + H2SO4 + H2O.
8. В каком направлении при стандартных условиях протекают реакции:
а) FeS2 + HNO3 конц  Fe(NO3)3 + NO + H2SO4 + H2O;
Fe(NO3)3 + NO + H2SO4 + H2O;
б) H2S + HNO3 конц., изб.  H2SO4 + NO + H2O.
H2SO4 + NO + H2O.
9. Напишите уравнения реакций взаимодействия между:
а) йодидом водорода и азотистой кислотой, при этом азотистая кислота восстанавливается до оксида азота (II);
б) медью и концентрированной азотной кислотой.
10. Напишите следующие уравнения реакций:
а) сульфида кадмия с азотной кислотой, при этом образуется элементарная сера и оксид азота (II);
б) алюминия с дихроматом калия, в сернокислой среде, при этом дихромат калия восстанавливается до сульфата хрома (III).
11. Закончите уравнения реакций окисления - восстановления с участием KMnO4, учитывая при этом, что  в KMnO4 в кислой среде восстанавливается до
в KMnO4 в кислой среде восстанавливается до  , в щелочной - до
, в щелочной - до 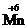 .
.
а) H3PO3 + KMnO4 + H2SO4  H3PO4 +...
H3PO4 +...
б) Na3AsO3 + KMnO4 + KOH  Na3AsO4 +...
Na3AsO4 +...
12. По приведенным ниже электронно-ионным схемам реакций составьте уравнения окислительно-восстановительных реакций (в молекулярном виде):
а) 10Fe2+ – 10e– = 10Fe3+;
2MnO  + 10e– + 16H+ = 2Mn2+ + 8H2O;
+ 10e– + 16H+ = 2Mn2+ + 8H2O;
б) 3Mg0 – 6e– = 3Mg2+;
SO  + 6e– + 8H+ = S0 + 4H2O;
+ 6e– + 8H+ = S0 + 4H2O;
13. Какой из окислителей - MnO2, PbO2, K2Cr2O7 - является наиболее эффективным по отношению к Hcl при получении cl2?
14. В каком направлении будет протекать реакция?
СrCl3 + Br2 + KOH  K2CrO4 + KBr + H2O
K2CrO4 + KBr + H2O
15. Можно ли при стандартных условиях окислить хлорид водорода до cl2 с помощью серной кислоты? Ответ подтвердите расчетом 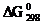 .
.
16. Какой объем 2 Н Нbr необходим для взаимодействия с 0,25 моль K2Cr2O7:
Нbr + K2Cr2O7  Kbr + CrBr3 + Br2 + H2O
Kbr + CrBr3 + Br2 + H2O
Какой объем брома при этом выделится?
17. Какую массу Al можно окислить с помощью 0,1 л 0,25 Н K2Cr2O7 по реакции: Al+K2Cr2O7+H2SO4  Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O
Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O
18. К подкисленному раствору KJ добавлено 0,04 л 0,3 Н KNO2:
KJ + KNO2 + H2SO4  J2 + K2SO4 + NO + H2O
J2 + K2SO4 + NO + H2O
Вычислите массу выделившегося йода и объем NO.
19. Смешаны подкисленные растворы: а) KNO3 и KMnO4; б) Fe2(SO4)3 и K2Cr2O7. Между какими из этих веществ будет протекать реакция и чем это определяется?
20. Могут ли одновременно существовать в растворе HJ и HClO3, Hbr и KMnO4?
21. Будет ли азотистая кислота: а) окисляться действием KMnO4 в нейтральной и кислой средах; б) восстанавливаться до NO сернистой кислотой? Для возможных случаев напишите уравнения реакций.
22. В кислый раствор, содержащий смесь солей Kcl, Kbr и KJ добавлено достаточное количество KNO2. Записать редокси-цепи, выражающие взаимодействие NO2-иона с каждым по отдельности галогенид-ионом (один из электродов NO  + 2H+/NO + H2O). Сопоставлением электродных потенциалов установить, какой из галогенид-ионов будет окисляться до свободного состояния и какие не будут. Для окисляющегося галогенид-иона написать молекулярное уравнение реакции.
+ 2H+/NO + H2O). Сопоставлением электродных потенциалов установить, какой из галогенид-ионов будет окисляться до свободного состояния и какие не будут. Для окисляющегося галогенид-иона написать молекулярное уравнение реакции.
23. В подкисленный раствор смеси солей Kcl, Kbr и KJ прибавлен в достаточном количестве раствор KMnO4. Записать редокси-цепи для каждого галогенид-иона, обозначить электродные потенциалы, отметить знаки полюсов, направление перемещения электронов: вычислить ЭДС цепей. Все ли галогенид-ионы могут быть окислены до свободного состояния действием перманганат-иона? Написать соответствующие ионные уравнения реакций окисления-восстановления. Какая из трех рассматриваемых реакций будет протекать наиболее и какая наименее интенсивно?
24. К раствору сульфида натрия прибавлена азотная кислота. Жидкость мутнеет вследствие образования свободной серы. Написать ионное уравнение реакции. Записать редокси-цепь, отвечающую данному случаю. Указать электрод-восстановитель и электрод-окислитель, направление перемещения электронов и ЭДС цепи.
25. Можно ли окислить Cr2(SO4)3 действием KMnO4 в кислой среде с получением K2Cr2O7? Записать электронно-ионные уравнения фаз восстановления и окисления (по типу ВФ2–ne–  ОФ2 и ОФ1+ne–
ОФ2 и ОФ1+ne–  ВФ1). Записать редокси-цепь, указать знаки полюсов. Вывести молекулярное уравнение протекающей реакции.
ВФ1). Записать редокси-цепь, указать знаки полюсов. Вывести молекулярное уравнение протекающей реакции.
Не нашли, что искали? Воспользуйтесь поиском: