
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
26. Составить таблицу электродных потенциалов алюминия в растворах с активными концентрациями Al3+: 1; 0,1; 0,01; 0,0001; 0,00001 моль/л и начертить кривую зависимости электродного потенциала от концентрации ионов.
27. Вычислить, как изменится электродный потенциал цинка, если концентрация раствора сульфата цинка, в который погружена цинковая пластинка, уменьшится от 0,1 до 0,01 н.
28. Вычислить ЭДС гальванического элемента Ni/NiSO4||CoSO4/Co,
если [Ni2+]=0,001 моль/л и [Со2+]=0,1 моль/л.
29. Вычислить ЭДС концентрационного элемента, составленного из двух водородных электродов, погруженных в растворы кислот с рН=2 и рН=4.
30. Имеются концентрационные цепи:
а) Ag/0,1 Н AgNO3 || 0,01 Н AgNO3/Ag;
б) Zn/0,0001 г-ион/л Zn2+|| 0,01 г-ион/л Zn2+/Zn
В отношении каждой из этих цепей вычислить электродные потенциалы и ЭДС.
31. Обозначить знаки электродов, указать направление потока электронов и вычислить ЭДС концентрационных цепей:
а) Pt, H2/0,001 Н Hcl || 0,02 M H2SO4/ H2, Pt;
б) Pt, H2/0,00001 Н Hcl || вода/ H2, Pt.
32. Сравнить ЭДС двух концентрационных цепей:
а) Zn/0,01 М ZnSO4 || 0,1 M ZnSO4/Zn;
б) Zn/0,001 М ZnSO4 || 0,01 M ZnSO4/Zn.
33. Указать знаки полюсов, направление потока электронов и ЭДС цепи (под обозначениями концентраций соответствующих растворов указаны степени диссоциации электролитов α):
Ag/0,001 Н AgNO3 || 0,01 Н AgNO3/Ag
α = 1 α = 0,6
34. Дана концентрационная цепь
+Ag/[Ag+] = 0,05 г-ион/л || [Ag+] = х г-ион/л/Ag–
ЭДС цепи Е = 0,118 В. Чему равна концентрация раствора AgNO3 при отрицательном электроде?
35. Имеется концентрационная цепь
+Cu/[Cu2+] = 0,1 г-ион/л || [Cu2+] = х г-ион/л/Cu–
Е - 0,059 В. Определить х.
36. Вычислите ЭДС и изменение энергии Гиббса для гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрациями ионов (моль/л): С  = 1,8
= 1,8 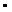 10–5, С
10–5, С  = =2,5
= =2,5 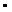 10–2. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов.
10–2. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов.
37. Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов С  = 1 моль/л, а у другого - 10–3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте исходя из величины ЭДС и
= 1 моль/л, а у другого - 10–3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте исходя из величины ЭДС и 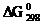 этой цепи.
этой цепи.
38. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов Ni2+ 10–4 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
39. Концентрационная гальваническая цепь составлена магниевыми электродами, погруженными в растворы MgSO4 разной концентрации: Mg/2 М MgSO4 || Mg/0,001 Н MgSO4
Кажущаяся степень диссоциации в 0,001 Н MgSO4 равна 87%. Определите степень электролитической диссоциации MgSO4 в 2М растворе, если ЭДС цепи равна 0,103 В.
40. Исходя из величины стандартных окислительно-восстановительных потенциалов и значения 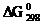 , определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
, определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
а)  – 2e– = Hg2+;
– 2e– = Hg2+;
б) PbO2 + 4H+ + 2e– = Pb2+ + 2H2O
41. Будет ли работать гальванический элемент, состоящий из водородных электродов, погруженных в 1 Н и 0,1 Н растворы КОН при 250С, если кажущаяся степень диссоциации растворов КОН соответственно равна 77 и 91%?
42. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ (в моль/л)?
43. Составьте схему работы гальванического элемента, образованного железом и свинцом, погруженными в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса.
44. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
45. При какой концентрации ионов Cu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода?
46. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
47. Гальванические элементы составлены по схемам:
а) Fe3+/Fe2+ || Ag+/Ag;
б) ClO  + 6H+/Cl– + 3H2O || 2J–/J2.
+ 6H+/Cl– + 3H2O || 2J–/J2.
Рассчитайте ЭДС этих элементов при стандартных условиях и найдите изменение энергии Гиббса протекающих в них реакций, уравнения которых напишите в ионно-молекулярной и молекулярной формах.
48. Как будет смещаться равновесие в системах при работе составленного из них гальванического элемента:
а) CrO  +2H2O/CrO
+2H2O/CrO  +4OH– и ClO–+2H+/Cl–+H2O;
+4OH– и ClO–+2H+/Cl–+H2O;
б) MnO2+4H+/Mn2++2H2O и NO  +H2O/NO
+H2O/NO  +2OH–.
+2OH–.
Напишите уравнения соответствующих реакций. Определить ЭДС и 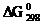 .
.
49. Нормальные потенциалы олова и свинца равны –0,14 В и –0,13 В. Покажет ли амперметр ток в гальваническом элементе, образованном из полуэлементов Sn|Sn2+ Cм = 1 моль/л || Pb2+ Cм= 0,46 моль/л |Pb.
50. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с рН 2 и рН 13? Какова ЭДС этого элемента?
ЭЛЕКТРОЛИЗ
51. Одной и той же силы ток одновременно пропускался через водный раствор H2SO4 и (в отдельном электролизере) через расплав хлористого цинка. В результате электролиза раствора серной кислоты получено 200 мл водорода, измеренных при 250 и 740 мм рт.ст. (газ сухой). Сколько теоретически должно выделиться цинка на катоде второго электролизера?
52. Электрический ток силой в 6 А в течение 1 ч 14 мин 24 сек осадил на катоде 8,14 г металла из химического соединения, в котором он двухвалентен. Чему равна атомная масса металла и какой это металл?
53. Электролизер содержит раствор Pb(NO3)2, анод свинцовый. Сила тока 5 А, продолжительность электролиза 2 ч 40 мин 50 сек. Вычислить теоретическую убыль в весе свинцового анода в результате электроокисления.
54. Деталь подверглась марганцеванию. Электролит - раствор MnSO4. Сила тока 5 А. Вычислить выход металла- покрытия (марганца) по току, если в течение 1 ч на поверхности детали выкристаллизовалось 3,078 г чистого марганца.
55. При электролизе водного раствора хлористого натрия было получено 600 мл 1 Н раствора NaOH (электролиз проводился с применением диафрагмы). В течение того же времени в серебряном кулонометре, включенном последовательно в цепь и содержащем раствор AgNO3, на катоде выделилось 52,56 г металлического серебра. Вычислить выход едкого натра в процентах от теоретического.
56. Деталь была оцинкована за 1 ч 40 мин. Электролит - раствор ZnSO4. Вес металла покрытия (т.е. Zn) составляет 7,8456 г. Выход по току 77,2%. Чему была равна сила тока?
57. Деталь хромируется в водном растворе Cr2(SO4)3. Сила тока 3 А. Определить продолжительность электролиза, если на поверхность детали необходимо нанести электрокристаллизацией 1,3 г хрома и если выход по току принять равным 40%.
58. Вычислить время, в течение которого должен быть пропущен ток 0,5 А через раствор серебряной соли, чтобы покрыть металлическую пластинку слоем серебра толщиной 0,02 мм, если общая поверхность пластинки 500 см3, а выход по току 95,5% (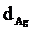 = 10,5 г/см3).
= 10,5 г/см3).
59. При электролизе водного раствора азотнокислого висмута на катоде выделилось в течение 1 ч 14 г висмута. Выход по току 94%. Вычислить силу тока.
60. Сколько электричества надо пропустить через раствор, чтобы получить 1 т NaOH при электролизе раствора NaCl? Выход по току 95%.
61. Вычислить количество электричества, которое надо пропустить через раствор CuSO4, чтобы получить 1 т меди. Выход по току 98%.
62. При электролизе раствора сульфата никеля током 10 А в течение 5 ч на катоде выделилось 53,21 г никеля. Вычислить выход по току.
63. Вычислить процентную концентрацию раствора, образовавшегося в результате электролиза 400 мл 10%-ного раствора гидроксида натрия (ρ = 1,1 г/см3), если известно, что при этом выделилось 56 л кислорода
(при н.у.).
64. 10 г гидроксида калия, содержащего примесь хлорида калия, растворены в воде, и раствор подвергнут электролизу. При этом на аноде выделилось 224 мл хлора (при н.у.). Вычислить процентное содержание примеси в гидроксиде калия, считая электролитическое разложение веществ полным.
65. Через 2 л 6%-ного раствора гидроксида калия (ρ =1,05 г/см3) пропущен электрический ток. В результате концентрация раствора изменилась (увеличилась или уменьшилась?) на 2%. Какие вещества и в каких количествах выделились при этом на электродах?
66. Через последовательно включенные в цепь постоянного тока растворы AgNO3 и CuSO4 пропускался ток силой в 5 А в течение 10 мин. Какая масса каждого металла выделится при этом на катодах?
67. При электролизе раствора, содержащего 76 г FeSO4, до полного разложения соли на катоде выделилось железо массой 13,44 г, а на аноде - кислород объемом 4,48 л (н.у.). Найдите выход по току для железа и кислорода.
68. Ток силой в 2 А в течение 1 ч 28 мин выделил на катоде (при 100%-ном выходе по току) 6,5 г металла. Найдите молярную массу его эквивалента.
69. При электролизе соли двухвалентного металла ток силой в 1 А в течение 1 ч выделил на катоде 2,219 г металла. Определите, какой это металл.
70. Какое количество электричества в кулонах и ампер часах потребуется для полного выделения никеля из раствора, содержащего его сульфат массой 30,9 г. Какой массы серная кислота образуется при этом в прианодном пространстве, какие газы и в каком объеме (н.у.) выделятся на катоде и аноде?
71. Ток силой 4 А пропускали через электролизер в течение 16 мин 5 с. За это время на катоде выделился свинец массой 4,14 г из расплава одного из его соединений. Определите, было ли это соединение двух- или четырехвалентного свинца.
72. При электролизе одного из соединений олова ток силой в 10 А за 3 мин выделил на электродах металл массой 0,554 г и хлор объемом 209 мл (н.у.). Найдите формулу этого соединения.
73. Через две электролитические ячейки, соединенные последовательно, пропускался электрический ток, который выделил на катоде первой ячейки медь массой 19,5 г из раствора CuSO4. Найдите массу цинка, который выделится при этом на катоде второй ячейки, если его выход по току составляет 60%.
74. Какое количество электричества в кулонах потребуется для полного электролитического разложения сульфата кадмия, содержащегося в растворе объемом 200 мл молярной концентрации эквивалента 0,5 моль/л. Найдите также массу продуктов электролиза по теоретическим расчетам.
75. Вычислите массовую долю примесей в черновом свинце, если при его очистке электролизом убыль массы свинцового анода, равная 414 г, сопровождалась выделением на катоде чистого свинца массой 372,6 г.
Не нашли, что искали? Воспользуйтесь поиском: