
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ХИМИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
101. Определите массовую долю (%) примесей в техническом карбиде кальция, если при полном разложении 1,8 кг образца водой образовалось 560 л ацетилена.
102. Рассчитав 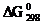 реакций взаимодействия Na2O, MgO и Al2O3 с серным ангидридом, ответьте, какой из процессов протекает более активно. Расчет вести на 1 моль.
реакций взаимодействия Na2O, MgO и Al2O3 с серным ангидридом, ответьте, какой из процессов протекает более активно. Расчет вести на 1 моль.
103. Определите массу Na2O2, вступившую в реакцию с водой, если общий объем полученного раствора NaOH 0,750 л, а 0,010 л этого раствора необходимо для нейтрализации 0,030 л 0,1 Н Hcl.
104. Вычислите тепловой эффект реакции 2Mg + CO2  MgO + C
MgO + C
если известно, что 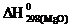 = –601,24 кДж/моль, а
= –601,24 кДж/моль, а 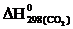 = –393,51 кДж/моль.
= –393,51 кДж/моль.
105. Рассчитайте 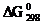 реакции термического разложения карбоната магния
реакции термического разложения карбоната магния
MgСO3 (К)  MgO (К) + CО2 (Г)
MgO (К) + CО2 (Г)
если изменения стандартной энергии Гиббса при образовании MgСO3 (К), MgO (К) и CО2 (Г) соответственно равны (кДж/моль): –1029,3; –569,6; –394,38.
106. Найдите объем сероводорода, выделившегося при взаимодействии 60 г магния с 500 мл раствора серной кислоты (ρ= 1455 кг/м3) с массовой долей H2SO4 55,5% при температуре 180С и давлении 96 кПа.
107. Вычислите массу MgSO4  7H2O содержащегося в 1 м3 раствора сульфата магния с массовой долей 20%. Плотность раствора 1219 кг/м3.
7H2O содержащегося в 1 м3 раствора сульфата магния с массовой долей 20%. Плотность раствора 1219 кг/м3.
108. Определите массовую долю (%) разложившегося карбоната стронция, если при прокаливании 10 кг карбоната стронция его масса уменьшилась на 1,7 кг.
109. Смесь карбоната и гидроксида кальция, содержащую 45% карбоната кальция, обработали раствором соляной кислоты (ρ=1200 кг/м3) с массовой долей Hcl 39%. Вычислите массу исходной смеси и объем соляной кислоты, вступившей в реакцию, если при этом выделилось 1,4 л газа (н.у.).
110. Рассчитайте количество теплоты, которое выделится при 250С при взаимодействии 12 г гидрида калия с водой, если 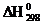 KH и КОН соответственно равны –56,9 и –374,47 кДж/моль.
KH и КОН соответственно равны –56,9 и –374,47 кДж/моль.
111. При растворении в кислоте 7,5 г оксида кальция, содержащего примесь карбоната кальция, выделилось 0,21 л газа (н.у.). Какова массовая доля (%) карбоната кальция в исходной смеси?
112. Магний раньше получали восстановлением хлорида магния с помощью натрия. Вычислить теплоту реакции, зная, что теплота образования MgCl2 равна 623,4 кДж, а теплота образования NaCl равна 409,5 кДж.
113. Сколько едкого натра получится при электролизе 1 м3 20%-ного раствора поваренной соли (ρ=1,151 г/см3), не учитывая производственных потерь? Какой объем водорода (н.у.) получится?
114. Хлор и водород, получаемые электролизом раствора NaCl, используют для производства соляной кислоты. Сколько кубических метров 18%-ного раствора поваренной соли (ρ=1,132 г/см3) должно быть подвергнуто электролизу, чтобы получить 1 т 30%-ного раствора соляной кислоты?
115. Сколько миллилитров 10%-ного раствора едкого натра (ρ=1,11 г/см3) требуется для осаждения всей меди в виде Cu(OH)2 из 0,6458 г CuCl2  2H2O?
2H2O?
116. Какой объем 1,00 Н раствора Hcl требуется для растворения 2,25 г MgСO3?
117. Какой объем 1,00 Н раствора (NH4)2CO3 требуется для осаждения ионов Ba2+ из раствора, в котором содержится 1,25 г BaCl2?
118. Какой массы потребуется карбонат натрия для нейтрализации раствора серной кислоты объемом 100 мл, если Сэ = 2 экв/л?
119. Какой объем раствора соды потребуется для полной нейтрализации ортофосфорной кислоты, содержащейся в ее растворе объемом 200 мл, если С 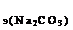 =2 экв/л, а С
=2 экв/л, а С 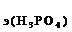 = 3 экв/л?
= 3 экв/л?
120. Гидрид кальция какой массы надо обработать водой, чтобы получить водород объемом 1000 м3 (н.у.)?
121. Какой объем СО2 (н.у.) и какую массу Ca(OH)2 можно получить из известняка массой 1 т, если он содержит 90% CaCO3?
122. При растворении в кислоте 5,00 г СаО, содержащего примесь CaCO3, выделилось 140 мл газа, измеренного при н.у. Сколько процентов CaCO3 (по массе) содержалось в исходной навеске?
123. Протекание какой из двух возможных реакций
а) N2O + 3Mg = Mg3N2 + 1/2 O2
б) N2O + Mg = MgO + N2
более вероятно при взаимодействии магния с N2O? Ответ обосновать расчетом 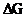 .
.
124. При прокаливании 30 г кристаллогидрата сульфата калия выделяется 6,28 г воды. Какова формула кристаллогидрата?
125. Можно ли получить кальций восстановлением его оксида алюминием? Ответ обосновать расчетом энергии Гиббса реакции.
126. Если C 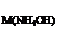 = 2 моль/л, то какой объем этого раствора был взят для осаждения Al(OH)3 из раствора (ρ= 1,3 г/л) объемом 200 мл, в котором массовая доля AlCl3 составляет 30%? К полученному осадку до его полного растворения прибавлен раствор NaOH концентрации 0,5 моль/л. Найдите его объем.
= 2 моль/л, то какой объем этого раствора был взят для осаждения Al(OH)3 из раствора (ρ= 1,3 г/л) объемом 200 мл, в котором массовая доля AlCl3 составляет 30%? К полученному осадку до его полного растворения прибавлен раствор NaOH концентрации 0,5 моль/л. Найдите его объем.
127. Какой объем (н.у.) CO2 можно получить из 1246 г мрамора, в котором массовая доля CaCO3 составляет 89,6%? Какой объем соляной кислоты с массовой долей 20% для этого потребуется?
128. Раствор NaNO2, молярная концентрация эквивалента которого равна 0,1 экв/л, взят объемом 25 мл. Какой объем раствора KMnO4 той же концентрации потребуется для окисления нитрита в сернокислой среде?
129. Какой объем раствора нитрита натрия, молярная концентрация которого 0,15 моль/л, потребуется для реакции с 10 мл раствора KJ (ρ= 1,12 г/мл), в котором его массовая доля соли составляет 15%. В какой среде протекает эта реакция? Вычислите массу каждого из образующихся продуктов.
130. Какая масса PbO2 потребуется для окисления в присутствии серной кислоты нитрита натрия, находящегося в 200 мл раствора (ρ= 1,12 г/мл)?
131. Какой объем раствора KNO2 концентрации 1 моль/л потребуется для выделения в кислой среде всего йода из 20 мл раствора KJ (ρ= 1,12 г/мл), в котором массовая доля KJ составляет 15%?
132. Напишите электронную формулу атома фосфора в нормальном и возбужденном состоянии. Чему равны максимальные значения ковалентности и степени окисления фосфора? Сравните с азотом и объясните причину сходства и различия.
133. Какой объем раствора NaOH концентрации 0,1 моль/л необходимо взять для нейтрализации Н3РО4, полученной из фосфата кальция массой 0,31 г?
134. Чему равен объем кислорода (н.у.), полученного из KClO3 и KMnO4, взятых массой по 1 кг?
135. Какой объем SO2 (н.у.) потребуется для полного обесцвечивания раствора KMnO4 объемом 250 мл, если его молярная концентрация эквивалента составляет 0,1 моль/л?
136. Найдите объем хлора, который выделится при взаимодействии K2Cr2O7 с раствором соляной кислоты объемом 250 мл, в котором массовая доля HСl составляет 30%, ρ= 1,48 г/см3).
137. Какой массы йод может быть получен при взаимодействии насыщенного раствора KJ: а) с хлором, объем которого равен 28 л (н.у.); б) с раствором объемом 50 мл, в котором массовая доля H2SO4 составляет 98%?
138. Найдите массу брома. который поглощается раствором гидроксида натрия объемом 300 мл, если С 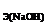 = 2 моль/л.
= 2 моль/л.
139. Газ, выделившийся при взаимодействии NaCl массой 5,85 г с концентрированной серной кислотой, пропущен через раствор AgNO3 (ρ= 1,1 г/мл) объемом 200 мл, в котором массовая доля соли равна 10%. Найдите массы образовавшегося при этом осадка и AgNO3, оставшегося в растворе.
140. Какой объем (н.у.) хлора потребуется для взаимодействия с 10 мл горячего раствора Ba(OH)2, в котором массовая доля гидроксида составляет 3,75% (ρ= 1,04 г/мл).
141. Напишите уравнение реакции получения металлического хрома из окиси хрома алюминотермическим способом. Сколько металлического алюминия потребуется для получения 10 кг хрома?
142. Олово получают восстановлением оловянной руды SnO2 углем по схеме:
SnO2 + С  Sn + CO2.
Sn + CO2.
Сколько тонн металлического олова можно получить из 10 т руды, содержащей 92% SnO2?
143. Сколько аммиачной селитры получается при нейтрализации 50 г 40% HNO3 аммиаком?
144. Какой объем хлора вступил в реакцию с натрием, если выделилось 49,11 ккал тепла?
145. Сколько необходимо хлористого водорода и воды для получения 1 кг 33%-ной соляной кислоты?
146. В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
147. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Al  Al2(SO4)3
Al2(SO4)3  Na[Al(OH)4]
Na[Al(OH)4]  Al(NO3)3.
Al(NO3)3.
148. Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
149. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций HNO2; а) с бромной водой; б) с HJ.
150. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной - с медью. Укажите окислитель и восстановитель.
151. Молярная концентрация эквивалента раствора K2Cr2O7 0,25 моль/л. Какой объем этого раствора надо взять для реакции с KJ в подкисленном серной кислотой растворе, содержащем йодид-ионы количеством вещества 0,01 моль?
152. Было приготовлено 200 мл раствора сульфата железа (II) из навески FeSO4  7H2O массой 27,80 г. Какой объем раствора KMnO4, для которого Сэ=0,1 экв/л потребуется на окисление в кислой среде FeSO4, содержащегося в приготовленном растворе объемом 50 мл?
7H2O массой 27,80 г. Какой объем раствора KMnO4, для которого Сэ=0,1 экв/л потребуется на окисление в кислой среде FeSO4, содержащегося в приготовленном растворе объемом 50 мл?
153. Уравнениями реакций покажите отношение: а) меди к азотной и серной кислоте; б) серебра к азотной кислоте; в) золота к “царской водке”?
154. Как можно осуществить указанные ниже переходы от одного соединения меди (II) к другому: а) сульфат  карбонат
карбонат  оксид
оксид  гидроксид
гидроксид  гидроксосульфат
гидроксосульфат  хлорид; б) Cu
хлорид; б) Cu  Cu(NO3)2
Cu(NO3)2  CuS
CuS  Cu(NO3)2
Cu(NO3)2  CuO
CuO  (CuOH)2SO4
(CuOH)2SO4  CuCl2
CuCl2  Cu.
Cu.
155. Какой объем раствора с массовой долей HNO3 8% (ρ= 1,045 г/см). потребуется для растворения меди массой 24 г? Чему должен быть равен объем NO (н.у.), который при этом выделится?
156. Дайте общую характеристику d-элементов II группы периодической системы. В чем проявляется устойчивость электронной конфигурации (n–1) d10 в атомах этих элементов?
157. Укажите возможные продукты восстановления серной кислоты цинком и напишите уравнения соответствующих реакций.
158. Какой объем раствора NaOH концентрации 2 моль/л потребуется для полного растворения Zn(OH)2 массой 9,9 г?
159. Учитывая электронную структуру атомов, их радиусы и ионизационные потенциалы, а также наиболее характерные валентные состояния, сделать вывод о том, к какому из элементов, марганцу или рению, ближе по химическим свойствам технеций.
160. Чем объяснить, что при большом различии в свойствах соединений марганца и хлора в низших валентных состояниях соединения этих же элементов в высших валентных состояниях имеют сходство? Сравнить Cl2O и MnO; Cl2O7 и Mn2O7.
161. Оценить термодинамическую возможность протекания в стандартных условиях реакций:
1) Mn(Т) + Н2О(Ж) = MnO(Т) + H2 (Г);
2) Mn(Т) + 2Н2О(Ж) = MnO2 (Т) + 2H2 (Г);
162. Как изменяется максимально возможная и наиболее характерная степени окисления атомов d-элементов VIII группы периодической системы по горизонтали и по вертикали?
163. Сравнить кислотно-основные свойства гидроксидов железа Fe(OH)2 и Fe(OH)3.
164. Чем объяснить, что химическая активность d-металлов понижается по периоду и по группам Периодической системы, в результате наименее активные, благородные металлы (Pd, Pt, Au и т.д.) концентрируются в VIII и I группах V-VI периодов системы?
165. Сравнить кислотно-основной характер гидроксидов CuOH и Cu(OH)2. Какой из этих гидроксидов обладает амфотерными свойствами? Написать уравнения реакций, подтверждающих его амфотерный характер.
166. Проанализировать термодинамическую возможность осуществления реакций:
2CuГ(Т) = CuГ2(Т) + Cu(Т);
2CuГ2(Т) = 2CuГ(Т) + Г2(Т);
в стандартных условиях для разных галогенидов меди, используя изобарно-изотермические потенциалы их образования (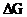 , ккал/моль):
, ккал/моль):
| CuГ | CuF2 | CuCl2 | CuBr2 | CuJ2 | CuF | CuCl | CuBr | CuJ |
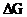
| –116,6 | –40,97 | –31,3 | –3 | –50 | –28,7 | –23,8 | –16,6 |
167. Химически чистый цинк почти не растворяется в разбавленных соляной и серной кислотах. Почему интенсивность взаимодействия с кислотами резко возрастает, если коснуться металла медной проволокой или добавить в раствор кислоты соль меди? Будет ли аналогичным образом влиять на процесс растворения цинка в кислоте введение солей свинца, ртути, магния?
168. Какую массу хрома можно получить из 2,5 т хромистого железняка FeO  Cr2O3, содержащего 15% посторонних веществ (пустой породы)?
Cr2O3, содержащего 15% посторонних веществ (пустой породы)?
169. На восстановление 0,05 л 0,2 Н K2Cr2O7 в присутствии разбавленной соляной кислоты затрачено 0,2 л раствора хлорида олова (II). Вычислите молярную концентрацию эквивалента раствора SnCl2.
170. Вычислите, какая масса дихромата калия потребовалась для приготовления 0,3 л 0,2 Н K2Cr2O7 (применительно к реакции окисления в кислой среде).
171. Кусок латуни массой 0,8 г растворен в азотной кислоте. При электролизе этого раствора на катоде выделилось 0,496 г меди. Напишите уравнения реакций и определите марку латуни, т.е. состав сплава (%).
172. Карбонил никеля может быть получен при действии оксида углерода на тонкодисперсный порошок металла. Процесс может быть выражен уравнением Ni (Т) + 4CO (Г)  [Ni(CO)4] (Г)
[Ni(CO)4] (Г)
Какой объем займет тетракарбонил никеля, если в реакцию вступило 23,48 г никеля, а производственные потери составили 10%?
173. Пирометаллургический процесс извлечения меди из сернистых руд можно выразить следующей схемой: CuFeS2 + O2 + SiO2  Cu + FeSiO2 + SO2
Cu + FeSiO2 + SO2
Какая масса меди получается из 5,8 г сульфида, содержащего 5% примесей, а выход реакции составляет 90% от теоретического? Какой объем (н.у.) займет выделившийся оксид серы (IV)?
174. Составьте уравнение реакции растворения Sc в разбавленной азотной кислоте. Какой объем азотной кислоты с массовой долей 15,53% (ρ= 1090 кг/м3) необходим для растворения скандия, если в результате
реакции образовалось 0,03 моль нитрата аммония?
Не нашли, что искали? Воспользуйтесь поиском: