
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
175. Под действием HNO3 манганаты диспропорционируют следующим образом: K2MnO4 + HNO3  KMnO4+ MnO2 + KNO3 + H2O
KMnO4+ MnO2 + KNO3 + H2O
Какой объем раствора азотной кислоты (ρ= 1185 кг/м3) с массовой долей 30% необходим для того, чтобы получить 9,48 г перманганата калия. Какая масса диоксида марганца образуется?
176. Определить величину и знак заряда комплексных ионов, образуемых Cr3+, [Cr(H2O)4Cl2]; [Cr(H2O)3Cl3]; [Cr(H2O)5Cl].
177. Определить заряд комплексообразователя в ионах [Co(NH3)5Cl]2+; [Co(NH3)4Cl2]+; [Co(NH3)3Cl3]0.
178. Координационное число Cо3+ равно 6. Написать возможные комплексы Cо3+ с NH3 и H2O в качестве лигандов.
179. Гидроксид алюминия растворяется в конц. NaOH с образованием комплексного иона [Al(OH)4]–. Напишите эту реакцию и найдите заряд иона-комплексообразователя.
180. Сколько требуется AgNO3 для осаждения ионов Cl– из 0,1 моля [Cr(H2O)5Cl]Сl2?
181. Представьте координационные формулы следующих соединений: 2Ca(CN)2 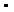 Fe(CN)2, K2C2O4
Fe(CN)2, K2C2O4 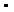 CuC2O4, KCl
CuC2O4, KCl 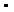 AuCl3, (NH4)4
AuCl3, (NH4)4 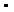 Fe(SO4)2, 2NH4Cl
Fe(SO4)2, 2NH4Cl  PtCl4.
PtCl4.
182. Назовите следующие комплексные соединения: [Co(H2O)2(NH3)4]Cl3; [Ti(H2O)6]Br3; [Cr(NH3)6](NO3)3; Ba[Pt(NO3)4Cl2]; K4[CoF6];
183. Напишите формулы следующих соединений: триоксалатокобальтата (III) натрия, хлорида дибромотетраамминплатины (IV), тетрароданодиаквохромата (III) калия, сульфата пентаамминаквоникеля (II), нитрата карбонатотетраамминхрома (III).
184. Указать комплексообразователь, его заряд и координационное число в комплексных соединениях: K4[Fe(CN)6]; K3[Fe(CN)6]; [Ag(NH3)2]Cl; K2[Cu(CN)4]; [Ni(NH3)6]SO4; K2[PtCl6].
185. Указать комплексообразователь, его заряд и координационное число в комплексных ионах: [Au(CN)2]–, [Cr(H2O)4Br2]2+; [Co(NH3)2(NO2)4]–; [Hg(CN)4]2–; [HgJ4]2–; [Ni(NH3)6Cl]+.
186. Нижеприведенные молекулярные соединения представить в виде комплексных солей: KCN  AgCN; Co(NO3)3
AgCN; Co(NO3)3  6NH3; CrCl3
6NH3; CrCl3  6H2O; 2KCNS
6H2O; 2KCNS  Co(CNS)2; 2KCN
Co(CNS)2; 2KCN  Cu(CN)2; 2KJ
Cu(CN)2; 2KJ  HgJ2.
HgJ2.
187. Определить степень окисления центрального иона (комплексообразователя) и назвать комплексные соединения: [Co(NH3)3(NO2)3]; K[Co(NH3)2(NO2)4]; K2[SiF6]; K[AuCl4]; K3[Fe(CN)6]; [Cr(H2O)6Cl3].
188. Написать химические формулы комплексных соединений, взяв внутренюю сферу комплекса в квадратные скобки: а) дициано-аргентат натрия; б) гексанитро-(III) кобальтат калия; в) хлорид гексаммин никеля (II); г) бромид гексаммин кобальта (III); д) нитрат дибромо-тетра-аква хрома (III); е) нитрат диаква-тетраммин никеля (II).
189. В практике ремонта деталей для их поверхностной обработки применяют желтую и красную кровяные соли. Их химические названия: гексациано-(II) феррат калия и гексациано-(III) феррат калия. Написать формулы этих солей с указанием внутренней сферы комплекса.
190. Написать уравнения первичной диссоциации в водном растворе солей, указать комплексные катионы и анионы, назвать их: [Ag(NH3)2]Cl; K4[Fe(CN)6]; [Cr(H2O)6]Cl3; [Co(NH3)5Cl]Cl2; [Cu(H2O)4]SO4.
191. Известны две комплексные соли кобальта, отвечающие одной и той же эмпирической формуле CoClSO4  5NH3. Одна из них в растворе с BaCl2 дает осадок BaSO4, но не дает осадка с AgNO3, другая с AgNO3 дает осадок AgCl, а с BaCl2 осадка не дает:
5NH3. Одна из них в растворе с BaCl2 дает осадок BaSO4, но не дает осадка с AgNO3, другая с AgNO3 дает осадок AgCl, а с BaCl2 осадка не дает:
а) написать формулы обеих комплексных солей;
б) написать уравнения диссоциации этих солей и назвать ионы;
в) написать молекулярные и ионные уравнения реакций взаимодействия солей с образованием осадка - в одном случае AgCl, а в другом - BaSO4.
192. Координационное число кобальта Co3+, как комплексообразователя, равно 6. Указать состав комплексных ионов (т.е. внутренней сферы комплекса) в солях CoCl3  6NH3, CoCl3
6NH3, CoCl3  5NH3, CoCl3
5NH3, CoCl3  4NH3, учитывая, что молекулы аммиака в них играют только роль лигандов. Назвать эти комплексные соли и написать уравнения их диссоциации в водных растворах.
4NH3, учитывая, что молекулы аммиака в них играют только роль лигандов. Назвать эти комплексные соли и написать уравнения их диссоциации в водных растворах.
193. Представить выражения для констант нестойкости (Кн) комплексных ионов: [Ag(CN)2]–; [Cu(NH3)4]2+; [Hg(CNS)4]2–; [Co(NH3)6]2+; [Ag(NH3)2]+; [Fe(CN)6]3–; [Fe(CN)6]4–; [Cr(H2O)4Cl2]+.
194. Ниже указаны константы нестойкости некоторых комплексных ионов:
| [Ag(CN)2]– | [Au(CN)2]– | [Cu(CN)4]2– | [Hg(CN)4]2– | |
| Кн | 10–21 | 5  10–39 10–39
| 5  10–28 10–28
| 4  10–41 10–41
|
Указать, в растворе какой из комплексных солей: K[Ag(CN)2], K[Au(CN)2], K[Cu(CN)4] или K[Hg(CN)4] при равной молярной концентрации концентрация CN–-ионов будет: а) наибольшей и б) наименьшей.
195. Сколько требуется миллилитров 0,1 Н раствора
AgNO3 для осаждения ионов Cl– из 25,0 мл 0,1 М раствора [Cr(H2O)5Cl]Cl2?
196. Определить заряды комплексообразователей в комплексных солях: K2[PtCl6]; K2[PtCl4]; K[AuCl4]; K[AuCl2]; K3[Fe(CN)6]; [Pt(NH3)2Cl2]; K4[Fe(CN)6].
197. Какие комплексные ионы входят в состав солей: K2PtCl6; KAu(CN)4; CrCl3  5H2O; K4Fe(CN)6; KAu(CN)2; CoCl3
5H2O; K4Fe(CN)6; KAu(CN)2; CoCl3  6NH3, если комплексообразователями в них являются ионы Pt4+; Au3+; Cr3+; Fe2+; Au+ и Co3+. Составьте уравнения диссоциации этих солей.
6NH3, если комплексообразователями в них являются ионы Pt4+; Au3+; Cr3+; Fe2+; Au+ и Co3+. Составьте уравнения диссоциации этих солей.
198. Составить выражения констант нестойкости комплексных ионов: [Сd(CN)4]2–; [Pt(NH3)4]2+; [Cu(CN)4]2–; [Ag(S2O3)2]3–.
199. Константы нестойкости ионов: [Сu(NH3)4]2+ 4,6  10–14; [Zn(NH3)4]2+ 2,6
10–14; [Zn(NH3)4]2+ 2,6  10–11; [Сd(NH3)4]2+ 1,0
10–11; [Сd(NH3)4]2+ 1,0  10–7. Какой из этих ионов более прочный?
10–7. Какой из этих ионов более прочный?
200. Константы нестойкости ионов: [Сd(CN)4]2– 1,4  10–17; [Ni(CN)4]2– 3,0
10–17; [Ni(CN)4]2– 3,0  10–16; [Hg(CN)4]2– 4,0
10–16; [Hg(CN)4]2– 4,0  10–14. В растворе какого комплексного иона будет содержаться больше ионов CN– при одинаковой молярной концентрации комплексных ионов?
10–14. В растворе какого комплексного иона будет содержаться больше ионов CN– при одинаковой молярной концентрации комплексных ионов?
Не нашли, что искали? Воспользуйтесь поиском: