
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ.
ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
ЭКОНОМИКИ И ТОРГОВЛИ
Имени Михаила Туган-Барановского
КАФЕДРА ЕСТЕСТВОЗНАНИЯ И БЕЗОПАСНОСТИ ЖИЗНЕДЕЯТЕЛЬНОСТИ
Секция химии
доц. Ищенко А.В.
КОНСПЕКТ ЛЕКЦИЙ по УЧЕБНОЙ ДИСЦИПЛИНЕ
«ХИМИЯ»
Отрасль знаний_____0505 „Машиностроение и металлообработка”
направление подготовки ______6.050503 „Машиностроение”
специальность (специализация) _ „Оборудование перерабатывающих
и пищевых производств”
«Холодильные машины и установки»
Институт пищевых производств
Курс ___1________________________________________________
Учебный год ____2015-2016__________________________________
ДонНУЭТ
Донецк
Лекция № 1
Основные понятия и законы химии.
План:
1. Атомы, молекулы, элементы.
2. Относительная атомная масса, относительная молекулярная масса, моль, молярная масса.
3. Закон сохранения массы вещества, закон постоянства состава.
4. Закон Авогадро. Следствия из него.
5. Эквивалент. Закон эквивалента.
1. Атомы, молекулы, элементы.
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Химические свойства атома определяются его строением.
Молекула – это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее свойством и химическим строением. Понятие молекулы и атома совпадают для одноатомных молекул например у благородных газов Ne, Ar.
Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом кристаллическом состоянии из молекул состоят лишь вещества имеющие молекулярную структуру. Вещества не молекулярной структуры - это большинство неорганических веществ состоят из ионов или атомов и существуют в виде макротел.
Если вещество состоит из одинаковых атомов – это вещество простое, если вещество состоит из разных атомов, то это сложное вещество или сложное химическое соединение.
2. Относительная атомная масса, относительная молекулярная масса, моль, молярная масса.
Так как массы атомов очень молы их традиционно измеряют не абсолютными, а относительными величинами (атомная единица массы). Атомная единица массы равна 1\12 массы атома углерода С12.
1а.е.м. = 1,66·10-27кг. = 1Д.
Относительная атомная масса – это относительное значение массы молекулы в атомных единицах массы или в Дальтонах.
Моль – это количество вещества, которое содержит 6,02· 1023 структурных единиц молекул, атомов, электронов. Масса вещества взятая в количестве 1моль называется молярной массой и выражается в граммах. 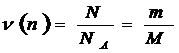 где
где
N – это число частиц в данной порции вещества.
NА – число Авогадро в 6,02·1023.
m – масса данной порции вещества.
М – молярная масса.
3. Закон сохранения массы веществ.
Масса веществ вступающая в химические реакции равна веществ образующихся в результате реакции.
Закон о постоянстве веществ.
Каждое вещество от способа его получения имеет постоянный качественный и количественный состав. Вещества которые подчиняются этому закону называются дальтонидами, из большинства веществ которые не подчиняются этому закону называются бертоллидами, их меньшинство. К бертоллидам относится например оксиды титана TiO0.65 – TiO0.25.
4. Закон Авогадро
Равные объемы всех газов при одинаковых условиях (давления и температуры) содержат одинаковое количество молекул.
Следствие:
1. Один моль любого газа при одинаковых условиях занимает один и тот же объем, при нормальных условиях этот объем равен 22,4 литра. 
2. Молярная масса вещества в газообразном состоянии равна его удвоенной относительной плотности по водороду 
Отношение молярной массы одного газа к молярной массе другого газа называется относительной плотностью первого ко второму.
5. Эквивалент.
а) Эквивалент – это такая формальная частица (она может быть реальной или условной) которая равноценна по химическому действию атома водорода данной реакции.
б) Эквивалент – это такая реальная или условная частица которая может присоединять, освобождать или быть каким то другим образом и эквивалентно одному атому водорода в данной реакции.
Эквивалент элемента Х обозначаются  .
. 

Z – валентность элемента.
В системе СИ основной единицей количества вещества является моль для эквивалента также используется моль например:
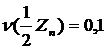 моль.
моль.
Масса моля эквивалента называется молярной массой эквивалента. Так например масса моля эквивалента Zn равна 32,68 гр. Zn. Молярная масса эквивалента алюминия 9 гр. Выражается молярная масса эквивалента гр/моль. Молярная масса эквивалента равна атомной массе деленной на валентность этого элемента. Эквивалент кислоты равняется молярной массе кислоты и деленной на количество протонов которые принимают участие в данной реакции. Эквивалент основания равняется молярной массе основания деленной на количество гидроксо групп принимающих участие в данной реакции. Эквивалент соли равняется молярной массе деленное на произведение количества атомов металла в соли на его валентность. Закон эквивалента вещества реагирует между собой или образуются в реакциях в массовых отношениях которые пропорциональны отношению их эквивалентов.
ЛЕКЦИЯ № 2
1. Строение атома.
Атом – состоит из ядра в котором сосредоточена вся масса атома. Вокруг ядра вращаются электроны. Центробежная сила противодействует силе притяжения электронов.
Атом состоит из протонов и нейтронов. Количество протонов равно порядковому номеру элементов периодической системе, т. е. Численно равно положительному разряду ядра. Количество нейтронов равно разнице между атомной массой элемента и количеством протонов. Так, например у лития Li количество протонов равно три, а нейтронов 7-3 = 4.
Размер атома равен 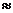 10-8 см. размер ядра 10-13 см.
10-8 см. размер ядра 10-13 см.
Порядковый номер элемента указывает число положительных зарядов ядра, а так же количество электронов вращающихся вокруг ядра.
Электроны в атоме распределяются по энергетическим уровням (слой или оболочка). Каждый электрон характеризуется четырьмя квантовыми числами n, l, m, s. Главное квантовое число n характеризует энергию электрона, а так же размер электронного облака. Оно может принимать значения целых чисел от 1 до  . Второе орбитальное квантовое число l характеризует энергетическое состояние электрона в подуровне и форму электронного облака. Электроны уровня группируются в подуровни. l принимает значение от 0 до n-1. Каждому значению l при одном и том же n соответствует определенный подуровень. Число подуровня равно номеру уровня l = 0, то s, если l = 1, то p, l = 2 то d, l = 3 то 1.
. Второе орбитальное квантовое число l характеризует энергетическое состояние электрона в подуровне и форму электронного облака. Электроны уровня группируются в подуровни. l принимает значение от 0 до n-1. Каждому значению l при одном и том же n соответствует определенный подуровень. Число подуровня равно номеру уровня l = 0, то s, если l = 1, то p, l = 2 то d, l = 3 то 1.
Каждому значению соответствует буквенное соотношение.
Если n = 1, то l = 0 число подуровней 1, и обозначается 1s.
Если n = 2, то l = 0 и 1 число подуровней 2, и обозначается 2s 2р.
Если n = 3, то l = 0, 1, 2 число подуровней 3, и обозначается 3s 3р 3 d.
Электроны c l = 0 называются s электронами.
Электроны c l = 1 называются р электронами.
Электроны c l = 2 называются d электронами.
Электроны c l = 3 называются f электронами.
s – облако имеет форму шара (сферическое).
p – oблако имеет гантелеобразную форму.
d и f – Имеет более сложную форму.
 Магнитно-квантовое число характеризует ориентацию орбитали в пространстве и равняется от + l до – l. Число значений магнитно- квантовых чисел m = 2 l + 1 это число орбиталей равное с данным значением l. Энергетическое состаяние электрона схематически изображается ячейкой так изображается атомная орбиталь.
Магнитно-квантовое число характеризует ориентацию орбитали в пространстве и равняется от + l до – l. Число значений магнитно- квантовых чисел m = 2 l + 1 это число орбиталей равное с данным значением l. Энергетическое состаяние электрона схематически изображается ячейкой так изображается атомная орбиталь.
| l | m | Кол-во ячеек | |
| s | 0 | 1 | 1 |
| p | 1 | +1,0,-1 | 3 |
| d | 2 | +2,+1,0,-1,-2 | 5 |
| f | 3 | от +3 до -3 | 7 |
Спиновое квантовое число обозначается s, характеризует собственное вращение электронов вокруг своей оси. Оно может принимать значение от +1,2 до –1,2.
Два электрона с одинаковыми значениями n, l, m но с разными значениями s, называется спаренными.
Принцип Паули – в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Общее количество электронов на энергетическом уровне определяется по формуле:
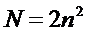
Наименьшей энергией обладают электроны первого уровня. Электроны последующих уровней обладают большим запасом энергии. Электроны внешних энергетических уровней могут отрываться и присоединятся к другим атомам на внешний энергетический уровень, при отрыве электронов от атомов образуется положительно заряженный ион. При присоединении электрона в атоме образуется отрицательно заряженный ион. Последовательность дополнения энергетических уровней описывается правилам Клечковского. Заполнение энергетических уровней атомов с увеличением порядкового номера элементов происходит последовательно с ростом суммы n + l. А при равных значениях n + l заполняется то которому соответствует большее число l.
1s – n + l = 1+ 0 = 1
2s – n + l = 2+ 0 = 2
2p – n + l = 2+ 1 =3
3s – n + l = 3+ 0 =3
3p – n + l = 3+1 =4
4s – n + l = 4+ 0 =4
3d – n + l = 3+2 =5
Порядок заполнения согласно правилу Клечковского 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d. Распределение электронов в атоме по уровням и подуровням изображаются в виде электронных формул, правило Хунда. Орбитали подуровня заполняются сначала по одному электрону, а затем по второму с противоположно направленными спинами.
| |||
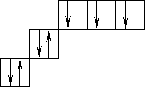 | |||

| |||
 | |||
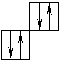
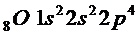
 |

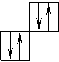
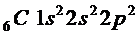
Лекция № 3.
1. Строение атома и периодический закон Д. И. Менделева Периодическая система.
1 марта 1869 года открыл периодический закон Д. И. Менделев. Свойства простых тел, соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Современная формулировка V от величины заряда атомных ядер. Демонстрацией периодического закона является периодическая система. Начинаются периоды элементов, у которых на s подуровне 1 электрон Li 2s1, Na 3s1, K 4s1, Rb 5s1.
Таким образом на внешнем энергетическом уровне у них находится 1 электрон. Элементы у которого заполняются s подуровень внешнего уровня,называются s - элементами, p подуровень p –элементами, d подуровень d - элементами. Так например во втором периоде Li и Be – это s – элементы.
Третий период содержит в начале 2s – элемента, Na и Mg, а затем 6 р – элементов.
Четвертый период начинается также с 2s элементов после этого расположены 10d элементов (у которых согласно правилу Кличковского заполняется с подуровней) и завершается период 6 р – элементов. s и р элементов находятся в главных подгруппах, d элементынаходятся в побочных группах. Элементы 1,2,3 периодов называются типическими, потому что их свойства измеряются типично: от активного щелочного металла в начале периода, затем несколько менее активных щелочноземельный металл, затем типичные не металлы, галогены и завершают период инертный или благородные газы. Активные свойства щелочных металлов обусловлены подвижностью s электрона на внешнем энергетическом уровне, чем легче атом отдает электрон тем больше выражены его металлические. Свойства в периоде слева на право металлические свойства уменьшаются, а не металлические увеличиваются. Металлические свойства сверху вниз усиливаются.
2. Энергия ионизации и средство электронов.
Энергией ионизацией – называется энергия необходимая для отрыва наиболее слабо связанного электрона от атома с образованием соответствующего иона. Энергия ионизации, выраженная в электрон вольтах численно равна потенциалу ионизации. Энергия ионизации в периоде возрастает с лева на право, а сверху вниз энергия ионизации уменьшается, т. к. увеличивается расстояние электронов от ядра. Атомы могут не только отдавать, но и присоединять электроны. Энергия, которая выделяется при присоединении к атому одного е называется средством электрона. При этом образуется анион. Наибольше значение этих величин у галогенов.
Электроотрицательность – это способность атомов в молекуле присоединять электроны. Электроотрицательность увеличивается слева на право, а по вертикали снизу вверх. Таким образом, самый электроотрицательный элемент F.
Лекция № 4-5.
Химическая связь.
План.
1. Ковалентная связь. Механизмы ее образования. Свойства, типы ковалентной связи.
2. Ионная связь.
3. Металлическая связь.
4. Водородная связь.
5. Межмолекулярные взаимодействия.
1. Ковалентная связь. Механизмы ее образования. Свойства, типы ковалентной связи.
Атомы в молекуле химических веществ соединены с помощью связи. Природа химических связей стала ясна только после изучения строения атома. Электроны на внешнем энергетическим уровням молекул атома могут полностью его заполнять или не полностью. Таким образом энергетические уровни могут быть завершенными и не завершенными. У s и p элементов валентными, т.е. участвующими в образовании связи являются электроны внешнего уровня. У d элементов в образовании связи участвуют электроны n, s подуровня и электроны (n-1)d подуровня. У f элементов валентными являются электрон n, s подуровня, (n-1)d подуровня, (n-2)f подуровня.
Различают три основных типа связи: ковалентная, ионная и металлическая. Согласно методу валентных связей образования ковалентных связей, например в молекуле Н можно объяснить следующим образом. При сближении двух атомов Н происходит перекрывание электронных облаков. Образуется между центром ядер молекулярное двух электронное облако имеющая максимальную плотность. Увеличение плотности отрицательного заряда способствует увеличению сил притяжения между ядрами и электронными облаками. Что сопровождается уменьшением энергии системы. Если спины электронов участвующих в образовании связей параллельны, связь не образуется, если спины антипараллельны – связь образуется.
1s1 1s1
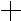
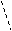

 – молекулярный энергетический уровень ниже чем
– молекулярный энергетический уровень ниже чем
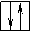 у исходных атомов, а значит состояние устойчивее.
у исходных атомов, а значит состояние устойчивее.
17Cl 1s2 2s2 2p6 3s2 3p5

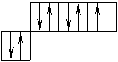 3p5 3p5
3p5 3p5
3s2 3s2
 |
В этих примерах образуется одна электронная пара между атомами. Связь называется однородной.
Однородная связь – это некратная связь, а остальные кратные связи. Химическая связь осуществляемая электронными парами, называется ковалентной (атомной) такая связь образуется при перекрывании одноэлектронных атомных облаков с противоположными спинами. Эта связь двух электронная и двуцентровая. Соединение с ковалентной связью называется гомеополярными или атомными.
Существует другой механизм образования ковалентной связи. Он называется донорно-акцепторный. Это механизм образования ковалентной связи за счет двух электронного облака одного атома (донор) и свободной орбитали другого атома (акцептор). Поэтому и связь называется донорно-акцепторной. Типичным примером образования ковалентной связи является образования катиона аммония.
2. Свойства ковалентной связи. Длинна связи. Энергия связи. Насыщаемость. Направленность.
Длинна связи – определяется экспериментально, чем меньше длинна связи тем оно прочнее. Однако мерой прочности является энергия связи.
Энергия связи – количество энергии которая необходима для разрыва связи. С увеличением кратности энергия увеличивается, а длинна уменьшается.
Насыщаемость – это способность атомов образовывать ограниченное число ковалентных связей.
Направленность ковалентной связи обуславливает пространственную структуру молекулы.
Так например молекула HCl - линейна, молекула Н2О – нелинейная. Так как связь образована р элементами атома кислорода, облака которых расположены по осям ординат т. е. Под углом 90°. Таким образом их угол в молекуле Н2О должен быть 90°. Но в действительности 104°. В молекуле аммиака угол равен 107° 3', а молекула имеет вид пирамиды. Ковалентные связи образованные много валентными атомами и всегда имеют пространственную направленность. Между направлениям ковалентных связей образуется валентный угол.
Отклонение реального валентного угла от теоретического навело на мысль о существовании гибридизации.
BeCl2
2p
 4Be 1s2 2s2 2p0 2s2 - основное состояние Be.
4Be 1s2 2s2 2p0 2s2 - основное состояние Be.

2s2 - два неспаренных электрона.
Ковалентная связь которая образуется при перекрывании облаков вдоль линии соединяющих центры называется сигма связью(δ- связь).
Ковалентная связь может быть полярной и не полярной. Полярная связь в молекуле Н2О, H2S, HCl, NH3.
Смещение связующего электронного облака в молекуле называется поляризацией.
Заряды атома в молекуле обозначается δ – это эфективный заряд. Количественной мерой полярности молекулы является электрический момент диполя. P = δ · l
l- длинна диполя, т. е. расстояние между центром тяжести положительних и отрицательных зарядов. Единицы измерения электрического момента диполя в СИ кулон\м.
В некоторых молекулах связь между атомами может быть полярной, а в целом молекула неполярная. Любую химическую связь можно изобразить в виде векторов, который направлен к более отрицательному атому. В том случае когда нам можно определить полярность молекулы, мы геометрически складываем эти векторы. Если геометрическая сумма векторов равна нулю - значит молекула неполярна, если не равна нулю – значит молекула полярна.


 О С О О
О С О О
 ∑ = 0 Н Н
∑ = 0 Н Н
∑≠ 0
Способность молекулы поляризоваться под действием внешнего электрического поля называется поляризуемостью.
Ионная связь – это связь обусловленная электростатическим притяжением между ионами. Ее еще называют электровалентной. Ионную связь образуют атомы имеющие большую разницу электроотрицательности, когда более электроотрицательный атом не просто смещает электронное облако на себя, а полностью забирает себе электрон, превращаясь при этом в отрицательно заряженный ион (анион). Атом который отдал свой электрон превращается в положительный заряженный ион (катион). Ионную связь можно считать крайнем случаем ковалентной полярной связью. Обычно ее образуют атомы элементов главных подгрупп, 1 и 2 группы, 6 и 7 группы. Например NaCl, NaBr, Na2S, KBr. Ковалентная полярная, неполярная и ионная связи отличаются значениями электрических моментов диполей р. Если р = 0 – неполярная связь. При р от 0 до 13·10-30 – полярная связь. При р больше 13·10-30 – ионная связь.
Металлическая связь осуществляется между атомами металлов, которые имеют один, два, три подвижных электрона на внешнем энергетическом уровне и свободные орбитали.
Например у Na 3s1 на s подуровне один электрон, р и d свободны. Li 2s1 p – пустой. Ca 4s2 2 – электрона, остальные уровни пустые. В результате чего электрон близ лежащих атомов металла обобществляются и превращаются в электронный газ, электроны при этом движутся по всем свободным орбиталям.
Металлической связью обусловлены физические свойства металла: высокая электропроводность, высокая теплопроводность, пластичность, и тд.
Водородная связь бывает внутримолекулярной и межмолекулярной. Она образуется между атомом водорода и более электроотрицательными атомами.
Вещества с межмолекулярной связью имеют аномально высокие температуры кипения.
3. Межмолекулярное взаимодействие.
Молекулы взаимодействуют с друг другом не только при образовании межмолекулярной водородной связью, но и во многих других случаях. Существует три типа межмолекулярного взаимодействия: ориентационное, индукционное, дисперсное.
Ориентационное взаимодействие – это взаимодействие между двумя полярными молекулами (сюда относятся и ионные молекулы).
При сближении полярные молекулы ориентируются друг относительно друга, противоположными концами диполей. Чем больше полярность в молекуле, тем прочнее связь. При увеличении температуры ориентационное взаимодействие уменьшается так как тепловое движение молекул нарушает ориентацию.
Индукционное взаимодействие – осуществляется между полярной и не полярной молекулой. При этом полярная молекула деформирует электронное облако не полярным. В результате у не полярной образуется временный электрический момент диполя, а затем обе молекулы реагируют как диполи. Индукционное взаимодействие не зависит от температуры.
Дисперсное взаимодействие – осуществляется между двумя не полярными молекулами. При движении электронов внутри молекулы в одной из них происходит небольшая мгновенная деформация электронного облака. В результате чего возникает асимметрия в распределении заряда, т.е. возникает диполь который существует очень короткое время. Этот диполь взаимодействует с соседней молекулой, такое взаимодействие и называется дисперсионным. На дисперсионном взаимодействии основан процесс сжижения благородных и элементарных двухатомных газов.
При межмолекулярном взаимодействии имеет место все три типа указанных сил, их часто называют вандервальсовыми силами. Они так названы в честь голландского физика-химика Ван-Дер-Вальса.
Количество химических связей которые образует тот или иной атом называют валентностью.
Лекция № 6
ОСНОВЫ ХИМИИ, ТЕРМОДИНАМИКИ.
План
1. Понятия о системе, фазе. Системы гетерогенные, гомогенные.
2. Тепловые эффекты реакции. Энтальпия. Закон Гесса. Следствия из него.
3. Понятия об энтропии и энергии Гиббса.
1. Понятия о системе, фазе. Системы гетерогенные, гомогенные.
Системой называется вещество или совокупность веществ реально или мысленно обособленных от окружающей среды. Составная часть системы называется фазой.
Фазы обособленны от основной части системы границы раздела. Если система не может обмениваться с окружающей средой ни веществом ни энергией, то она называется изолированной.
Химические реакции протекающие в многофазных системах называются гетерогенными, а протекающие в однородной системе гомогенными. Механизм этих двух типов реакции сильно отличаются: гетерогенные реакции протекают только на границе раздела фаз, гомогенные протекают во всем объеме системы.
Сущность химической реакции сводится к разрыву одних связей в исходных веществах, и образованию новых связей продуктов реакции, при этом общее число атомов до и после реакции не изменяется. Так как при разрыве связей энергия поглощается, а при образовании новых связей энергия выделяется.
Химические реакции сопровождаются энергетическими эффектами. Обычно энергия выделяется или поглощается в виде теплоты, поэтому признаку реакции делятся: на эндотермические и экзотермические.
Экзотермические реакции – это реакции, которые идут с выделением тепла.
Например: Н2 + Cl 2 = 2HCl ∆H = - 184,6 кДж/моль.
В этих реакциях выигрыш энергии обусловленный образованием новых связей, больше расхода энергии на разрыв старых связей.
Эндотермические реакции – это реакции, которые идут с поглощением энергии.
Например: N2 + O2 = 2NO ∆Н=180,8 кДж/моль.
2. Тепловые эффекты реакции. Энтальпия. Закон Гесса. Следствия
Количество энергии поглощенной или выделенной в процессе реакции в виде теплоты, называется тепловым эффектом реакции. Раздел химии изучающий тепловые эффекты химических реакций, называется термохимией. Уравнения химических реакций с указанием тепловых эффектов называется термохимическими. Так как тепловой эффект зависит от давления и температуры договорились относить это к давлениям. Р=101,3кПа Т=298К(25ºС)
В тепло химических реакциях указывают агрегатное состояние вещества: (г) –газ, (ж) – жидкость, (к) – кристаллическое вещество.
Тепловой эффект в реакциях ∆Н выражается в кДж и относится к тому числу молей вещества, которая указана в уравнении реакции. У эндотермических реакциях ∆Н>0 у экзотермических реакциях ∆Н<0. Если конечные продукты реакции и исходные вещества находятся в стандартных условиях (Р=101,3 кПа).то ∆Н называют стандартной эктопией и обозначают 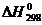 .
.
H2( г )+Cl2( г )=2HCl( г ) ∆  = -184,6 кДж/моль.
= -184,6 кДж/моль.
½H2( г )+½Cl2( г )=HCl( г ) ∆  = -92,3 кДж/моль.
= -92,3 кДж/моль.
N2( г )+O2( г )=2NO( г ) ∆  = 180,8 кДж/моль.
= 180,8 кДж/моль.
½N( г )+½O2( г )=NO( г ) ∆  = 90,4 кДж/моль.
= 90,4 кДж/моль.
Очевидно, что если реакция соединения протекает с выделением теплоты, то обратная реакция разложения будет идти с поглощением того же количества теплоты.
Тепловой эффект химической реакции измеряют с помощью калориметра. Термохимические расчеты основаны на законе Гесса и следствии из него. Закон был основан Гессом в 1840г.
Закон Гесса – тепловой эффект (или измерение энтольпии) реакций зависят только от начального и конечного состояния реагирующих веществ и не зависят от промежуточных стадий.
C(графит) + O(Г) = CO2(г) ∆H
∆H = H2 – H1 = -80
C(графит) + ½ O2(г) = CO(г) ∆Н1
CO(г) + ½ О2(г) = СО2(г) ∆Н2
∆Н = ∆Н1 + ∆Н2
Таким образом тепловой эффект прямого сгорания графита или через промежуточные стадии равен.
Следствие из закона Гесса:
- изменение энтольпии реакции равно разности между суммой теплот образования (∆Нобр). продуктом реакции суммой теплот образований исходных веществ. При алгебраическом суммировании учитываются стехиометрические коэффициенты.
mA + nB = pC + dD
∆H = (p∆Hобр с + d∆HобрD) – (m∆HобрА + n∆Hобрb)
Теплотой образования (энтольпией) называется тепловой эффект реакции образования одного моля вещества из простых веществ устойчивых при стандартных условиях.
Стандартные энтольпии (теплоты образования) известные для 8000 соединений. Теплота образования простых веществ равны нулю. С помощью справочных данных и следствия из закона Гесса можно рассчитывать тепловой эффект любой реакции.
3. Понятия об энтропии и энергии Гиббса.
Химические реакции протикают как с уменьшением Н (∆Н< 0) так и с увеличением Н (∆Н > 0). Иногда ∆Н = 0. Например: гелий, неон инертные газы, при смешивании происходит увеличении беспорядка, такое состояние более вероятно.
Оценивает беспорядок энтропией и обозначается буквой 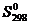 . В системах где ∆Н = 0 самопроизвольно протекают процессы с увеличением энтропии. ∆S = S2-S1; при этом ∆S > 0. Если порядок в системе уменьшается энтропия увеличивается это происходит при: растворении кристаллов и правлении сублимации (возгонка), повышение температуры. Если порядок увеличивается энтропия уменьшается это происходит при: отвердевании, конденсации, сжатии, кристаллизаций, полимеризаций понижению температуры.
. В системах где ∆Н = 0 самопроизвольно протекают процессы с увеличением энтропии. ∆S = S2-S1; при этом ∆S > 0. Если порядок в системе уменьшается энтропия увеличивается это происходит при: растворении кристаллов и правлении сублимации (возгонка), повышение температуры. Если порядок увеличивается энтропия уменьшается это происходит при: отвердевании, конденсации, сжатии, кристаллизаций, полимеризаций понижению температуры.
Для расчетов используют стандартные значения энтропии. Для определения энтропии в реакции пользуются следствием из закона Гесса.
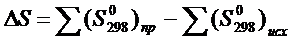
На направление течения физического или химического процесса влияет уменьшение внутренней энергии энтольпии ∆Н и увеличенье энтропии ∆S.
Чтобы их сравнивать нужны одинаковые единицы измерения. ∆Н измеряется в кДж/моль, ∆S – кДж/моль·К  ∆S·Т.
∆S·Т.
Внутренняя энергия системы состоит из двух частей из свободной энергии, которая может быть превращена в работу. Из связанной энергии которая в ходе процесса не может превратится в работу. Свободная энергия системы при постоянном давлении и температуры называется изабарно изотермическим потенциалом или энергией Гиббса и обозначается буквой G. В природе самопроизвольно протекает без затраты работы только те процессы, которые сопровождаются уменьшением свободной энергии – энергией Гиббса. Так если энергией Гиббса в начальном состоянии G1 и в конечном состоянии G2, то самопроизвольный переход системы из начального состояния в конечное возможен при условии G1>G2. Тогда ∆ G=G2–G1>0. Наоборот переход из конечного состояния в начальное возможен при условии G1<G2, тогда ∆ G>0. Если G1=G2, тосистема находится в равновесии. G=H-T·S;
∆G = ∆H – T∆S.
Чем больше возрастание энтропии тем меньше ∆ G и полнее протекает реакция в прямом направлении. Для вычисления ∆ G пользуются следующим уравнением:
∆ G= 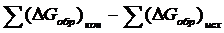
где ∆ Gобр – это изменение энергии Гиббса при образовании соединений из простых веществ. Обычно расчеты проводят при стандартных условиях Р =101,3 кПа, Т = 298 К. И тогда ∆ G обозначается ∆ G0298 эти значения для большинства веществ известны. И так если ∆ G>0, то реакция в прямом направлении самопроизвольно не протекает, необходимо поступление энергии из вне. Если ∆ G гораздо больше 0 т.е. имеет большое положительное значение, реакция возможна только в обратном направлении. Способность веществ к химическому взаимодействию иначе называются химическим сродством. Мерой химического сродства служит измерение свободной энергии Гиббса в каждой реакции. Чем больше отрицательная величена ∆ G тем выше реакционная способность.
ЛЕКЦИЯ № 7
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ.
План
1. Скорость химической реакции. Основной закон химической кинетики.
2. Зависимость скорости реакции от температуры.
3. Энергетические активации.
4. Гамагенный и гетрогенный катализ.
5. Химическое равновесие.
6. Принцип Ле Шателье.
1. Скорость химической реакции. Основной закон химической кинетики.
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ или одного из продуктов реакции. В единицу времени при неизменном объеме. Единицей измерения скорости является моль в числителе в знаменателе литр·секунду.
Основной закон химической кинематики:
– скорость химической реакции пропорциональна концентрации реагирующих веществ.

где  ,
, 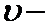 коэффициент пропорциональности.
коэффициент пропорциональности.
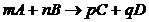
 =
= 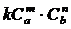 где
где  и
и 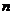 - это стеохимический коэффициент.
- это стеохимический коэффициент.
Основной закон химической кинематики не учитывает реагирующие вещества находящиеся в твердом состоянии. Так как их концентрация постоянна и они реагируют только на поверхности и которая остается не измененной. Как например при горении угля: С + О2 → СО2 реакция происходит между молекулами кислорода и твердого вещества только на поверхности раздела фаз. А значит масса твердой фазы не влияет на скорость реакции. В данном случае скорость реакции пропорциональна только концентрации кислорода.
2. Зависимость скорости реакции от температуры.
Зависимость скорости реакции от температуры определяется правилом Вант Гоффа: при повышении температуры на каждые 10° скорость реакции (большинства) увеличиваются в 2-4 раза. Математически эта зависимость выражается формулой
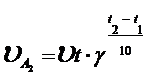
где  - начальная,
- начальная,  - до которой нагрели,
- до которой нагрели,  температурный коэффициент, он измеряется от 2 – 4.
температурный коэффициент, он измеряется от 2 – 4.
3. Энергетические активации.
Сильное увеличение скорости реакции с возрастанием температуры объясняет энергия активации. Согласно этой теории химическое взаимодействие вступают только активные молекулы, не активные молекул можно сделать активными, если сообщить им даже минимальную энергию – этот процесс называется активация. Один из способов активации увеличение температуры.
Энергию, которую нужно сообщить молекулам (или частицам) реагирующих веществ, чтобы превратить их активные называют энергией активации. Ее величена определяется экспериментально и выражается в кДж/моль и обозначают Е. Энергия активации зависит от природы реагирующих веществ и служит характеристикой реакции. Чтобы исходные вещества образовали продукт реализации, они должны преодолеть энергетический барьер.
При этом образуются переходное состояние или активированный комплекс, который потом расходуется на продуты реакции.
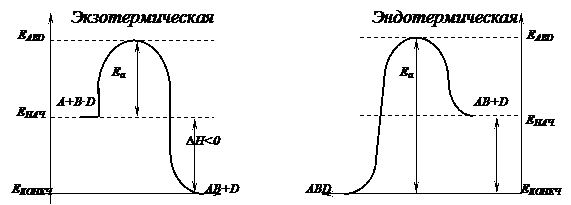
Скорость реакции зависит от энергетической активации, если энергия активации маленькая, то скорость большая и наоборот. Для активизации используют нагревание, облучение, катализаторы.
4. Гомогенный и гетерогенный катализ.
Катализ – это вещество изменяющая скорость реакции.
Положительный катализ – это вещество увеличивает скорость реакции.
Отрицательный катализ – это уменьшение скорости реакции.
Иногда скорость реакции изменяют сами продукты реакции или исходные вещества, такой процесс называют автокатализ. Катализ мажет быть гомогенным и гетерогенным. При гетерогенном катализе реагирующие вещества катализатором образуют систему из розных фаз и существует поверхность раздела, на которой и протекает реакция. При этом важную роль играет адсорбция – это концентрирование газообразных или растворенных веществ на поверхности других веществ которые называются адсорбенты.
Гомогенный катализ – это такой катализ когда реагирующие вещества и катализаторы находятся в одном агрегатном состоянии т.е. образуют однофазную систему.
5. Химическое равновесие.
Реакции которые протекают только в одном направлении и идут до конца называются необратимыми. Большинство реакций обратимы, т.е. идут в двух направлениях, прямом и обратном.
Химическое равновесие – это такое состояние системы при котором скорости противоположных реакций ровны.
Например при 3500 С.
H2 + I2 = 2HI;
V1 = k1[H2] [I2];
V2 = k2[HI]2,
где k1 = k2; 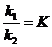
при постоянной температуре 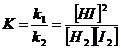
Реакция в общем виде:
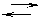 тА+пВ рС+
тА+пВ рС+ 

Таким образом К равно отношению константы скоростей прямой и обратной реакции и она показывает во сколько раз скорость прямой реакции больше скорости обратной реакции. Если концентрации реагирующих веществ равны каждая по 1 моль/метр. В этом физический смысл константы скорости.
[П1]
6. Принцип Ле Шателье.
Если на систему находящуюся в равновесии оказано внешнее воздействие, то равновесие смещается в направлении той реакции которая уменьшает это воздействие.
N2 + H2 = 2NH3; ∆H = - 46 кДж/моль.
Увеличение концентрации азота и водорода смещает равновесие вправо. Увеличение концентрации аммиака влево. Так как реакция экзотермическая, то повышение температуры смещает равновесие влево, а понижение температуры вправо.
Изменение давления.
Увеличение давления приводит к смещению равновесия вправо, а уменьшения давления влево.
ЛЕКЦИЯ № 8
Растворы.
План.
1. Общая характеристика растворов.
2. Разбавленные растворы не электролитов.
3. Растворы электролитов.
4. Произведение растворимости.
5. Водородный показатель.
6. Гидролиз солей.
. 1. Общая характеристика растворов
В природе широко распространены дисперсные системы – это такие системы в которых одно вещество равномерно распределено в виде частиц, между частицами другого вещества. В дисперсионных системах различают дисперсную фазу – это мелко раздробленное вещество и дисперсионную среду - это однородное вещество в котором распределена дисперсная фаза, к дисперсионным системам относятся истинные растворы, коллоидные растворы, суспензии и эмульсии. В истинных растворах размер частиц мелко раздробленного вещества не превышает одного нн.м. В коллоидных растворах от 1 до 100 нн.м. Если размер частиц больше 100 нн.м., то это суспензии или эмульсии. Например глина в воде.
Если дисперсная фаза жидкое вещество – это эмульсия. Например молоко.
Суспензия, эмульсия и коллоидные растворы – это гетерогенные системы. Истинные растворы – это гомогенные системы состоящие из двух и более составных частей и продуктов их взаимодействия, по агрегатному состоянию растворы бывало жидкие, твердые и газообразные. Жидкие растворы например: соль в воде, твердые растворы например: сплав никеля и меди, газообразный раствор например: воздух.
Важнейшая характеристика раствора это его концентрация – содержание растворенного вещества в определенной массе или объеме раствора или растворителя – концентрированный раствор. Содержит такие количества растворенного вещества, которые сравнимы с количеством растворителя. Разбавленный раствор содержит меньше растворенного вещества.
Способ выражения концентрации растворов.
1. массовая доля растворенного вещества – это безмерная величена равная отношению массы вещества к массе раствора.
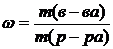
2. Молярная концентрация равно количество молей растворенного вещества в одном литре раствора. 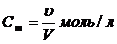
3. Нормальная концентрация Сн – количество молей растворенного вещества в одном литре раствора. 
4. Молярная доля равна отношению количества молей растворенного вещества к суммарному количеству молей веществ находящихся в растворе.
5. Молярная концентрация (в) равна отношению количества молей растворенного вещества к массе растворителя.
Растворимость веществ – это свойство веществ растворяться в воде или другом растворителе. По растворимости вещества делятся на три группы: хорошо растворимые, малорастворимые и не растворимые.
Растворы бывают: не насыщенные, насыщенные и пересыщенные.
Насыщенным называется такой раствор который находится в динамическом равновесии с избытком растворяемого вещества т.е. сколько частиц вещества переходит в раствор столько и кристаллизуется. При этом ∆G=0.
В не насыщенном растворе ∆G<0 веществ содержится меньше.
В пересыщенном растворе ∆G>0 веществ содержится больше чем в насыщенном растворе.
Количественно растворимость выражают концентрацией насыщенного раствора т.е. растворимость – это число граммов вещества, которое может растворять в100г. растворителя при данной температуре.
При понижении температуры вещества из раствора может выделяться кристаллизация при этом выделяется вещество в чистом виде даже если в растворе находятся примеси. На этом основан метод отчистки химического вещества, который называется перекристаллизацией.
При растворении жидкости в воде некоторые из них смешиваются во всех соотношениях, а другие смешиваются до определенного предела. Тогда образуется двухслойная система. С увеличением температуры растворимость жидкости увеличивается, при некоторой температуре они уже обе смешиваются, такая температура называется критической температурой растворения.
При растворении газа в воде зависимость другая растворимость газа в воде подчиняется закону Генри: при постоянной температуре растворимость газа пропорциональна его парциальному давлению.
Сж = k·p, где k – постоянная температуры, р – парциальное давление газа.
Растворение веществ может быть: экзотермическим и эндотермическим. В результате взаимодействия веществ с растворителем образуются сольваты (гидраты). Иногда эти соединения прочные и выпадают в виде кристаллов содержащих молекулы воды – кристаллогидратов.
2. Разбавленые растворы не электролитов.
Вещества которые расподаются на ионы в расплавах или растиорах называются электролитами, которые не росподаются называются не электролитами.
к электролитам относятся кислоты, основания соли, к не электролитам относятся почти все органические вещества. в разбавленных растворах не электролитов малекулы друг с другом не взаимодействуют, они ведут себя как идеальрые газы. например если в сосуд налить раствор сахарозы, а с верху слой чистой воды, то через некоторое время концентрация раствора сахарозы станет одинаковой во всем объеме, в результате диффузии молекул. такая диффузия диухсторонняя. если раствор сахарозы поместить в емкость из полупроницаемой мембраны (цилофан), то диффузия будет односторонней молекулы воды будут просачиваться в раствор сахарозы – это называется осмос.
Осмос – это односторонняя диффузия.
Осмотическое давление – это то давление которое необходимо приложить к раствору, чтобы прекратить осмос. Осмотическое давление растворенно пропорционально концентрации растворенного вещества и обсалютной температуре.
Закон Вант Гоффа: осмотическое давление розбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество если бы оно притой же температуре находилось в газообразном состоянии и занимало объем раствора.
π = cRT,
где с – концентрация в молях на метр. R – универсальная газовая постоянная. Т – абсолютная температура.
Давление. Пары растворов.
Пар находящийся в равновесии с жидкостью называется насыщенным. Жидкость закипает когда давление ее пара достигает внешнего атмосферного давления. При растворении не летучего вещества давление пара получающегося раствора всегда меньше давления пара чистого растворителя и растворителя над раствором называется понижением давления пара растворителя.
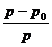 – отн.
– отн.
Первый закон Рауля: относительное положение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
|

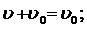

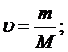
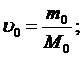
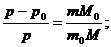
Таким образом его относительному понижению давлению насыщенного пара растворителя над раствором можно определить М – молярную массу растворенного вещества на М0 – массу растворителя.
Криоскопия, эбуллиоскопия.
Температура кипения раствора всегда выше чем чистого растворителя, а температура замерзания раствора ниже чем температура замерзания растворителя.
∆t – это понижение температуры замерзания.
∆tў - это повышение температуры кипения.
Второй закон Рауля.
Повышение температуры кипения раствора прямо пропорционально его молельной концентрации.
∆t ў= EC,
∆t = KC.
Понижение температуры замерзания прямо пропорционально его молельной концентрации. К – криоскопическая постоянная. Е – это эбуллиоскопическая постоянная.
Они зависят только от природы растворителяи не зависят от природы вещества. Их величины известны. Измерение ∆t называется криоскопией, а измерение ∆t ў называется эбуллиоскопией.
3. Растворы электролитов.
При изучении растворов электролитов оказалось, что они не подчиняются законам Рауля, Ван Гоффа. Чтобы распространить эти законы на растворы электролитов ввели газо-тонический коэффициент.
П=icRT, где і – это изотонический коэффициент, он показывает во сколько раз опытные величины больше теоретических. Если i=2 значит частиц в растворе электролита в 2 раза больше чем следовало ожидать, если в 3 то в 3 раза больше, в 4 то в 4 раза больше.
Чтобы объяснить эти отклонения, а также способность растворов электролитов проводить электрический ток. Шведский химик Аррениус предложил теорию электролитической диссоциации:
1. электролиты при растворении в воде распадаются на ионы;
2. под действием тока, катионы движутся к катоду, анионы к аноду;
3. диссоциация процесс обратимый, обратный процесс ассоциация.
Кислотами в свете теории электролитической диссоциации называются электролиты, которые при диссоциации образуют в качестве катионов только ионы Н+.
Основность кислоты - это количество ионов водорода, которая может образовать при диссоциации.


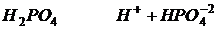

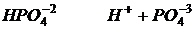
Основания в свете теорию электролитической диссоциации - это вещества которые при диссоциации образуют ионы гидрокса.



Соли в свете теорию электролитической диссоциации - это вещества которые при диссоциации образуют катион металла и ион кислотного остатка.


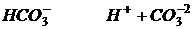

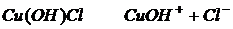

Диссоциация характеризуется степенью диссоциации, где a - отношение числа распавшихся молекул на общее число молекул.
|
1. природы растворителя;
2. природы растворенного вещества;
3. температуры;
4. концентрация раствора;
5. наличие одноименных ионов.
Сильные электролиты диссоциируют практически полностью. К ним относятся:
1. почти все растворимые соли;
2. сильные кислоты;
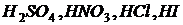
3. основания щелочных и щелочноземельных металлов.
Слабые электролиты диссоциируют частично. К ним относятся:
1. почти все органические кислоты;
2. слабые минеральные кислоты: 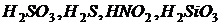
3. некоторые соли: 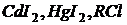
4. многие основания металлов, кроме сильных;
5. вода.
Ионные уравнения реакции.
Так как электролиты диссоциируют на ионы, то реакции между ними в растворе по суте являются реакциями между ионами.
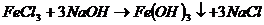
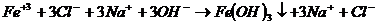
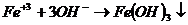
Первая реакция в молекулярном виде. Вторая неполное уравнение реакции. Третье краткое ионное уравнение реакции. До конца идут реакции в четырех случаях:
- образование осадка;
- выделение газообразного вещества;
- образования малой диссоциирующего соединения;
- образования комплексного соединения.
Амфотерные электролиты - это электролиты которые при диссоциации образуют ионы H+ и ОН-.
Примером является вода и гидроксид аммония.
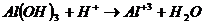
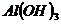 – может реагировать с кислотами и с щелочами.
– может реагировать с кислотами и с щелочами.
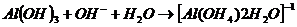
Произведение растворимости.
Для количественной характеристики способность электролитов растворяться, используется произведение растворимости. Произведение растворимости - это произведение равновесных молярных концентраций в степенях равных стехиометрическим коэффициентам. В насыщенном растворе:
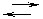

 < ПР AgCl – не насыщенный.
< ПР AgCl – не насыщенный.
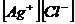 = ПР AgCl – насыщенный.
= ПР AgCl – насыщенный.
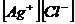 > ПР AgCl – перенасыщенный (осадок выпадает).
> ПР AgCl – перенасыщенный (осадок выпадает).
Произведение растворимости - величена постоянная температуре (смотреть в справочнике).
Водородный показатель.
 Вода это слабый электролит. Н2О Н++ ОН–
Вода это слабый электролит. Н2О Н++ ОН–
Экспериментально установлено, что для воды произведение эти ионов равно 10-14. [ Н+ ] [ ОН– ] = 10-14
Когда [ Н+] = 10-7 – среда нейтральная.
Если [ Н+ ] > 10-7 – среда кислая.
Если [ Н+ ] < 10-7 – среда щелочная.
Для количественной характеристики концентрация ионов водорода в растворе пользуются водородным показателем рН= десятичному логарифму концентрации ионов водорода взятому с обратным знаком. Таким образом, если рН<7 среда кислая, если рН =7 нейтральная, если рН>7 среда щелочная.
Для определения среды растворов пользуются индикаторами (фенолфтанол), при рН=8,2-10 приобретает красно-фиолетовый цвет. Метилоранж при рН=3,1– 4,4 приобретает красно-желтый цвет. Лакмус в слабо кислой среде приобретает красный цвет.
Буферные растворы - это растворы с определенной концентрации ионов водорода, которые незначительно изменяются при разбавлении, концентрировании, а также при добавлении небольших количеств кислот и щелочей. Типичный пример буферного раствора - это раствор белка, который во внутренних средах живых организмов рН на постоянном уровне (на определенных пределах).
Гидролиз солей.
Гидролизом называется взаимодействие ионов соли с водой приводящего к образованию слабого электролита. Гидролизу подвергаются соли образованные сильным основанием и слабой кислотой. При этом образуется щелочная среда и гидролиз идет по аниону.
Например: кислая соль гидрокарбонат натрия.
Не нашли, что искали? Воспользуйтесь поиском:

