
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Окислительно восстановительные реакции. Электрохимические процессы.
План.
1. Сущность процессов окисления восстановления.
2. Основные положения теории оислительно восстановительные реакции.
3. Эквивалент окислителя и восстаовителя.
4. Классификация окислительно восстановительные реакции.
5. Гальванические элементы.
6. Электродные потенциалы.
7. Химические источники тока.
8. Коррозия металла и защита от коррозии.
1. Сущность процессов окисления восстановления.
Все реакции подразделяются на реакции двух типов:
1) реакции которые идут без применения степени окисления на атомах 
2) реакции которые идут с изменением степени окисления на атомах. 
Реакции идущие с изменением степени окисления на атомах входящих в состав реагирующих веществ называются окислительно восстановительными.
Окислительно восстановительные реакции - это реакции в процессе которых происходит переход электронов от одних атомов молекул или ионов к дригим.
2. Основные положения теории окислительно-восстановительные реакции.
1. Окисления - это процесс отдачи электрона атома молекулой или ионом. Степень окисления при этом увеличивается.
2. Восстановление - это процесс присоединения электронов, степень окисления при этом уменьшается.
3. Атомы молекулы или ионы отдающие электроны называются восстановителями, а присоединяющие электроны окислителями. Так как атомы, молекулы или ионы входят в состав вещества то и эти вещества называются соответственно окислителями или восстановителями.
4. Окисление всегда сопровождается восстановлением и наоборот. Число электронов отдаваемых восстановителем равно числу электронов, присоединяемых окислителем.
Например: 


Важнейшие окислители и восстановители.
Восстановители: металлы, водород Н2, углерод С и уголь СО – оксид углерода, Н2S – сероводород, Na2S, SO2, H2SO3 – сернистая кислота и ее соли, HCl, HBr, HI, SnCl2, FeCl2, FeSO4, MnSO4, HNO2, HN3, альдегиды, спирты, муравьиная и щавеливая кислота, глюкоза. Важнейшие окислители галогены: Mn2O7, MnO2, KmnO4, CrO3, K2CrO4, K2CrO7, HNO3, H2SO4, CuO, Ar2O, PbO2 ионы благородных металлов: Ar+, FeCl3, гидпохлориды, хлораты, перхлораты, царская водка.
3. Эквивалент окислителя и восстаовителя.
Эквивалент окислителя - называют такое количество окислителя, которое присоединяет один моль электронов в данной окислительно восстановительные реакции.
Эквивалентная масса окислителя равна его молярной массе, деленной на число присоединенных одной молекулой окислителя выраженной в грамм молях. Соответственно определяется эквивалент и молярная масса эквивалента восстановителя

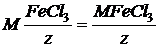
4. Классификация окислительно-восстановительные реакций.
Они бывают:
межмолекулярные;
внутримолекулярные;
диспропорционирования.
Межмолекулярные окислительно восстановительные реакции - это реакции при которых атомы, молекулы, ионы, с изменяющей степенью окисления находятся в разных молекулах.
Внутримолекулярные окислительно восстановительные реакции - степень окисления изменяется у разных атомов в одной и той же молекуле.
Диспропорцианирование окислительно восстановительные реакции - это когда изменяется степень окисления на одном и том же атоме.

5. Гальванические элементы.
 Химические процессы, которые сопроваждаются возникновением электрического тока или сами вызываются им называются электрохимическими. Гальванический элемент – это устройство в котором на основе ОВР получают электрический ток т.е. химическая энергия реакции превращается в энергию электрического тока. Самый простой гальванический элемент медно-цинковый.
Химические процессы, которые сопроваждаются возникновением электрического тока или сами вызываются им называются электрохимическими. Гальванический элемент – это устройство в котором на основе ОВР получают электрический ток т.е. химическая энергия реакции превращается в энергию электрического тока. Самый простой гальванический элемент медно-цинковый.
 – анод.
– анод.
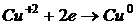 – катод.
– катод.

Так как на цинковом электроде идет процесс окисления он называется анодом, его принято считать отрицательным, а медный электрод – катод, принято считать положительным, причина возникновения и протекания электрического тока в гальваническом элементе, это разность электродных потенциалов.
6. Электродный потенциал.
При погружении металла в растворе их солей одни из них заряжаются положительно (менее активные металлы), другие на оборот отрицательные (более активные металлы). В результате образуется два слоя с противоположными зарядами, так называется двойной электронный слой.
Например:

–  + Е – потенциал электрода
+ Е – потенциал электрода
– + Е0 – стандартный электродный потенциал
– + n – зарядность иона металла
– + а – активность иона
– +
– +
Активность иона или молекулы – это концентрация соответственно которой они действуют в растворе.
У более активного металла в раствор уходит ион, а в самом металле остаются электроны. У менее активных металлов наоборот.
Разность потенциалов возникающих между металлом и окружающей его водной средой при наступлении равновесии называют равновесным электродным потенциалом или потенциалом электрода. Равновесный потенциал металла в растворе соли того же металла обычно записывают так:


Потенциалу приписывают тот знак который возникает на металле в двойном электронном слое, этот потенциал также называется ОВП. Электродные потенциалы являются постоянной величиной при данной температуре. Если пластинка опущена в стандартный раствор такой потенциал называется стандартным электродным потенциалом, непосредственно измерить потенциал отдельного электрона нельзя, его измеряют относительно другого электрона. Чаще всего для этой цели используют стандартный водородный электрод. Он состоит из платиновой пластинки покрытой платиновой черней. Этот электрод погружают в водный раствор серной кислоты определенной концентрацией и омывают его струей газообразного водорода, под определенным давлением. Величину потенциала такого электрода принимают за нуль. Стандартный потенциал электрода посылающий электрон к водородному электроду имеют знак «–», а принимающий электрон от водородного электрода имеют знак «+». Располагая металлы в порядке возрастания алгебраической величены их стандартных электродных потенциалов Е0 получают электрохимический ряд напряжений металлов или точнее ряд стандартных электродных потенциалов металла. Большинство стандартных электронных потенциалов металла можно определить экспериментально, однако для щелочных и щелочноземельных металлов значение Е0 рассчитывают только теоретически так как эти металлы взаимодействуют с водой. Ряд стандартных электродных потенциалов характеризует химические свойства металлов, при этом величины этих потенциалов количественно характеризуют восстановительную способность металлов и окислительную способность их ионов. Чем меньше алгебраическая величена потенциала тем выше восстановительная способность этого металла и тем ниже окислительная способность ионов.
Li –самый сильный восстановитель, Аи – самый слабый восстановитель. Ион Аи – самый сильный окислитель, а ион Li – самый слабый. Каждый метал, в этом ряду обладает способностью вытеснять все сведущие из растворов их солей. Однако бывают исключения, например Al вытесняет Cu из раствора CuC2l2 но практически не вытесняет его из раствора CuSO4. Это объясняется тем, хлорид иона гораздо быстрее разрушает поверхностную защиту, пленку из оксида алюминия, чем сульфат послы. Все металлы с отрицательным Е0 т.е. расположенные до Н вытекают из разбавленного раствора кислот, анионы которых не проявляют окисляющего действия и при этом растворяются. Е0 можно пользоваться для характеристики химической активности металла в окислительно-восстановительных реакциях протекающих в водной среде. Чем больше разность Е0 двух металлов, тем больше ЭДС будет у гальванического элемента построенного из них. ЭДС у любого гальванического элемента всегда положительная величина. Для того чтобы ее определить, нужно из потенциала электрода, имеющего большую алгебраическую величину, вычесть потенциал электродной алгебраической величины, которая меньше.
 = – 0,76 ЭДС = 0,34 – (-0,76) = 1,1 В
= – 0,76 ЭДС = 0,34 – (-0,76) = 1,1 В
 = +0,34
= +0,34

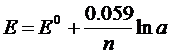
E0 – стандартный нулевой потенциал
n – зарядность иона металла
а – активность иона
Активность иона – это концентрация соответственно которой они действуют в растворе.
Электроны будут переходить от металла с более отрицательному потенциалу, к металлу с более положительному потенциалу. Окислительно-восстановительные реакции всегда протекают в сторону образования более слабых окислителей и восстановителей.
Если ΔG<0 и значение её велико, реакция самопроизвольно протекает только в прямом направлении.
Если ΔG>0 то реакция самопроизвольно протекает только в обратном направлении.
Если ΔG=0 система находится в равновесии.
Электролиз как окислительно-восстановительный процесс.
Если в растворе или в расплаве электролита (например NaCl t пл.-80ºC) погрузить электроды и пропустить постоянный электрический ток, то ионы Na катионы направятся к катоду, там примут электрон и превратятся в Na+, анионы Cl направятся к аноду, там отдадут электрон и превратятся в Cl2. Таким образом на катоде восстанавливаются Na на аноде окисляется Cl.
На катоде при электролизе происходит восстановление, на аноде окисление. Катод имеет заряд «–», анод «+». Электролиз как окислительно-восстановительный процесс протекающий на электродах при прохождении электрического тока через раствор или расплав электролита. Позволяет за счет электрической энергии осуществить химические реакции. Прибор в котором идет электролиз называется электролизер или электролитическая ванна.
При электролизе раствора в процессах могут участвовать молекулы воды.
Катодные и анодные процессы.
На катоде восстановительный процесс водных растворов может протекать:
1. Катионы металлов имеющих стандартный электродный потенциал больше чем у водорода (от Cu+2 до Au+3) при электролизе практически полностью восстанавливает на катоде.
2. Катионы металлов имеющих малую величину стандартного электродного потенциала (от Li+ до Al+3) не восстанавливает на катоде, а вместо них восстанавливаются молекулы воды. 
3. Катионы металлов имеющие стандартные электродный потенциал меньше чем у Н, но больше чем у Al, при электролизе на катоде восстанавливаются одновременно с молекулами воды. Если же водный раствор содержит катионы разных металлов, то при электролизе выделения их на катоде протекает в порядке уменьшения стандартного электродного потенциала соответствующего металлу. Так например из смеси катионов Ag+, Cu+2, Fe+2 сначала будут восстанавливаться катионы Ag (Е0= +0,8), затем катионы Cu (Е0= +0,34), катионы Fe (Е0= –0,44).
Реакции протекающие на аноде зависят от вещества из которого сделано оно и от присутствия молекул воды. Аноды подразделяются на растворимые и нерастворимые. Нерастворимые делают из угля, графита платины. Растворимые делают из меди, серебра, цинка и других металлов.
На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом легче окисляются анионы без кислородных кислот.
Если же в среде содержатся анионы кислородных кислот, то на аноде окисляются не они, а молекулы воды.

Рассматриваемый анод при электролизе окисляется т.е. посылает электроны во внешнюю цепь.

Применение электролиза широко используется для защиты металлических изделий от коррозии. На поверхности металла наносится тончайший слой другого металла Cr, Ar, Cu, Au, Ni. Иногда эти покрытия многослойные. Например внешние детали автомашины сначала покрывают тонким слоем Cu, затем тонким слоем Ni, а на него слой Cr. Этот раздел электрохимии называют гальваностегией. Кроме защиты от коррозии такие покрытия придают красивый декоративный вид.
Другая отрасль электрохимии – гальванопластика, используются для получения точных металлических копий с различных предметов. Для этого предмет покрывают воском и получают матрицу все углубления копируемого предмета на матрице будут выпуклостями. Поверхность восковой матрицы покрывают тонким слоем графита, для того чтобы она проводила электрический ток. Графитный катод опускают в ванну с раствором сульфата меди, анодом служит медь. При электролизе медный анод растворяется, а на катоде осаждается медь. Таким образом получается точная медная копия.
Электролиз используется также для получения многих металлощелочных, щелочноземельных, Al, лантоноидов и некоторых других. А также для очистки некоторых металлов от примесей.
7. Химический источник тока.
Устройство, вырабатывающее электрический ток за счет энергии окислительно-восстановительной реакции называют химическим источником тока или гальваническими элементами. Простейший пример – медно-цинковый элемент. В других часто используемых гальванических элементов используются не два электролита, а один. Эти элементы относятся к первичным источникам тока. После разряда такие элементы не пригодны к работе. Ко вторичным химическим источникам тока относятся аккумуляторы. Они могут быть использованы многократно. После разрядки аккумулятора его работоспособность может быть восстановлена пропусканием тока от внешнего источника в обратном направлении (электролиз). Анод аккумулятора при разрядке служит катодам. Наиболее распространены свинцовый, кислотный и железоникелевый щелочной аккумулятор. Свинцовый аккумулятор состоит из двух свинцовых пластин, одна из которых после зарядки заполнена губчатым свинцом (анод), а другая РвО2 (катод). Электролитом служит 30% раствор серной кислоты. В железоникелевом аккумуляторе масса анода, является губчатое железо.
Особой разновидностью химическим источником тока является топливные элементы или электрохимические генераторы. В топливных элементах химическая энергия в реакциях горения окисления топлива непосредственно превращается в электрическую, его КПД – превышает 80%. Обычно в топливных элементах используют жидкое или газообразное топливо. Твердое топливо уголь, как торф мало реакционно-способное. Оно может окислено только при очень высоких температурах. Из жидких топлив, наиболее интересны: метиловый, этиловый спирты, формальдегид, пары бензина, этилен, бутан, пропан, и другие газообразные углероды. Горючие газы (водяной, генераторный). В качестве окислителя применяют воздух или кислород, реже Br. Электролиты могут быть растры щелочей или кислот, расплавленные карбонаты или гидроксиды металла, тугоплавкие твердые электролиты.
Топливные элементы имеют высокий КПД. В них нет движущихся частей, конструкция проста, мощность на единицу объема и массы высокая работают бесшумно, без выделения вредных выхлопных газов и копоти. Поэтому они широко используются в спутниках, космических аппаратах в электрохимической промышленности.
8. Коррозия металлов.
Под коррозией металлов понимают его разрушение под действием окружающей среды. Это процесс самопроизвольный.
Виды коррозии.
Коррозия - это окислительно-восстановительный процесс протекающий на границе раздела фаз. Она может протекать в газах, в воде, в воздухе, в растворах электролита, в органических растворителях. Металлы при этом окисляются, а вещества, с которыми взаимодействуют, восстанавливаются.
Основные виды коррозии определяют характер разрушения металлов.
1. сплошная (равномерная и неравномерная), при этом разрушение охватывает всю поверхность металла;
2. местная при этом поражения локальные, а большая часть не затронута;
3. интеркристаллитная или межкристаллитная, коррозия продвигается в глубь металла по границам зерен;
4. транскристаллитная, при этом металл рассекает трещина через зерна;
5. избирательная (селективная) при этом в сплаве разрушается один компонент;
6. под поверхностная - это коррозия которая начинается с поверхности, а затем разрушает под поверхностные слои.
По механическим различают два типа коррозии: химическую и электрохимическую.
Химической коррозией называют разрушение металла окислением его в окружающей среде без возникновения электрического тока в системе. В этом случае происходит взаимодействие металла с составными частями среды: газами и не электролитами. Большой вред приносит окисление металла кислородом воздуха, т. е. газовая коррозия.
Скорость окисления многих металлов сильно возрастает при повышенной температуре, так на железе уже при 250-300°С появляется видимая пленка оксидов, при 600°С и выше поверхность металла покрывается слоем окалины, состоящей из FeO, Fe3O4, Fe2O3. окалина не защищает железо от дальнейшего окисления, т. к. сдержит трещины, поры, через которые может проникать кислород. Поэтому при нагревании железа выше 800°С скорость его окисления быстро растет.
У некоторых металлов контакт с кислородом воздуха сильно замедляет процесс коррозии. Потому что на поверхности металла образуется защитная оксидная пленка, которая препятствует проникновению к металлам, как газов, так и жидкостей. Такой металл переходит в пассивное состояние. Например: концентрированная азотная кислота легко пасcивирует железо, на его поверхности образуется защитная пленка и железо перестает реагировать с концентрированной азотной кислотой. Подобные защитные пленки образуются так же на алюминии, бериллии, хроме и цинке.
Электрохимическая коррозия - это разрушение металла в среде электролита с возникновением внутри системы электрического тока. В этом случае помимо химических процессов отдача электронов, протекают и электрические, перенос электрона от одного участка к другому. Например коррозия железа в контакте с медью в растворе электролита соляной кислоты. При этом возникает гальванический элемент где медь это катод, а железо анод.
Электрохимическую коррозию вызывают в основном примеси других металлов и не металлических веществ или неоднородность поверхности. При электрохимической коррозии поток электронов направлен от более активного металла к менее активному проводнику. При этом более активный металл парадирует. Скорость коррозии тем больше чем дальше расположены друг от друга металлы в ряду стандартных электродных потенциалов. Наиболее важными случаями электрохимической коррозии является атмосфера. Интенсивность такой коррозии увеличивается с ростом влажности воздуха содержанием в нем СО2 и SО2 пыли, копоти, от наличии шероховатости и влаги на поверхности металла.
Почвенная коррозия
Особенно коррозионно активны почвы с высокой влажностью с низким значением РН, и хорошей электрической проводимостью.
Болотистые и торфянистые, в таких условиях если не принять мер защиты трубопроводы разрушаются за полгода.
Не нашли, что искали? Воспользуйтесь поиском: