
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Жылу двигателi. Карно циклi 5 страница

|
| таралу функциясы үшін і |
алатын болсақ, ол оң болу керек, функция кинетикалық энергия шексіз артқан кезде, ол да шексіз артуы тиіс, ал мүнда физикалық мағына жоқ.Соншалықты қарапайым тұр қабылдайтын бүл формула жылдамдықтар бойынша таралудың максвелдік заңын береді. Оның накты айқын түрін табу үшін А. және а түрақтыларды табу керек. Бүл үшін

|
шамасын аламыз. Сонда түрін қабылдайды. Мүнда кіретін интеграл Пуассон интегралы деп аталады. Математикалық талдау курсында оның
| Бүрынғы айнымалыны пайдалансақ, онда: |

|

 болатындығы дәлелденеді. Осы нәтижені пайдаланатын болсақ, онда:
болатындығы дәлелденеді. Осы нәтижені пайдаланатын болсақ, онда:

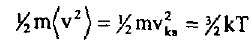
|
Мөселе енді тек а шамасын анықтауға ғана тіреліп түр. Бүл үшін X осі бойындағы жылулық қозғалыстың (ех) орташа кинетикалық энергиясы-ның <р таралу функциясы арқылы

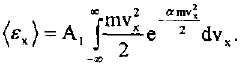

|
| Беліктеп интегралдау арқылы |

|
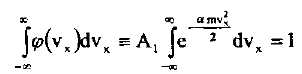
|

|
қатынасымен өрнектелетіндігін ескереміз» немесе толығырақ:
алатын болсақ, ол, өзіміз коргендей, симмет-риялы жөне оның координаттар басында максимумы болады.

функцияның максимумына
сәйкес келетін жылдамдық ең ықтимал жылдамдық деп аталады. Оны

|
| депбеліілейміз |

|
жылдамдықты табу үшін
| функцияны |
аргументгің функциясы д  еп
еп
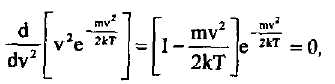
|
қарастырған ыңгайлы. (1.35)-ті осы аргумеиг бойынша дифференциалдап, алынған нәти-жені нөлге теңестіріп,
деп табаныз, осыдан

|
| болып анықталады. |

| мәнін қойып және интегралдап, |
Молекуланык орташа немесе орташа арифметикалық жылдамдығы белгілі жолмен деп табамыз. Осыларға тағы да молекуланың орташа кинетикалық энергиясын анықтайтын орташа квадраттық жылдамдықты қосамыз:
Сонда бүл жылдамдық мынаған тең болады:

Бүл үш жылдамдықтардың сандык. көбейткіштерінде ғана айырмашылық

|
Билет.
Газ молекулаларының жылдамдықтары. Штерн тәжірбиесі

|
Газдардың кинетикалылық теориясының негізгі теңдеуі молекулалардың ілгерілемелі қозғалысының орта кинетикалық энергиясымен абсолют температураның арасындағы байланысты тағайындайды:
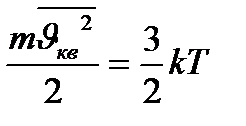 , бұдан
, бұдан  -(1.36), ал
-(1.36), ал 
Клайперон-Менделеев теңдеуінен: 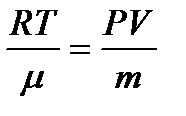 немесе
немесе 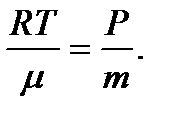
Осыны (1.36) теңдеуге қою мынаны береді: 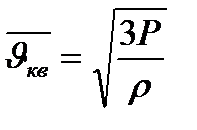 .
.
Яғни, газ молекулаларының орта квадрат жылдамдығы таза макроскопиялық шамалар – қысым мен тығыздық арңылы анықталады.Мысалы, азот үшін 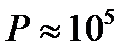 Па қысымда, оның тығыздығы
Па қысымда, оның тығыздығы 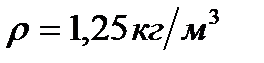 сонда
сонда

 .
.
Тәжірбиелерден газ молекулаларының жылдамдығы, олардың дыбыстың таралу жылдамдығымен шамалас болатыны анықталды. Бұл дыбыс толқындары молекулалардың қозғалысынан пайда болатындығының айқын дәлелі болып табылады. Жалпы газ молекулаларының жылдамдықтары әр түрлі. Оларда жылдамдығы өте төмен молекулалармен қатар, орта квадрат жылдамдықтан әлдеқайда жоғары жылдамдықпен қозғалатын молекулалар да кездеседі.
Газ молекулаларының жылдамдықтарын анықтаудың маңызы зор, себебі, ол газдардың кинетикалық теориясында үлкен рөл атқаратын,Больцман тұрақтысын k, тәжірбие арқылы анықтауға мүмкіндік береді. Жоғарғы ваккумде газ молекулаларының өзара соқтығысулары жоққа тән, бұл кезде олар тек ыдыс қабырғаларымен әсерлеседі. Бұл құбылыс металдарды жоғарғы ваккумде буландыру молекулалық немесе атомдық шоқтар алуға болатынын білдіреді.
Штерн тәжірбиесі
1920 ж. алғаш рет молекулалардың жылдамдығын тәжірбие жүзінде анықтаған, неміс ғалымы Отто Штерн. Құрал өзара берік бекітілген радиустары R мен r екі каоксиалды сыртқы және ішкі цилиндрлерден тұрады. Олардың осіне күміспен қапталған платина сым керіліп қойылды, ал ішіндегі қысым 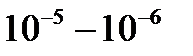 мм. с.б. дейін төмендетілді. Платина сым арқылы электр тогын жіберіп оны күмістің балқу температурасына (960
мм. с.б. дейін төмендетілді. Платина сым арқылы электр тогын жіберіп оны күмістің балқу температурасына (960  ) жуықтағанша қыздырады. Бұл кезде платинаны қаптаған күміс буланып, одан босаған молекулалар шоғы ішкі цилиндрдің саңылауынан шығып сыртқы цилиндрдің экрандалған ішкі бетіне жетіп қонады.
) жуықтағанша қыздырады. Бұл кезде платинаны қаптаған күміс буланып, одан босаған молекулалар шоғы ішкі цилиндрдің саңылауынан шығып сыртқы цилиндрдің экрандалған ішкі бетіне жетіп қонады.
Бүкіл жүйе 2500-2700 айн/мин бүрыштық жылдамдықпен қозғалатындай есеппен жасалады. Жүйе тыныш тұрса, экранда саңылаудың кескінін қайталайтын күміс қабаты пайда болады. Ал ол  бұрыштық жылдамдықпен айналса күміс атомдары, айналу бағытына қарама-қарсы бағытта, саңлаудың экрандағы кескінінен
бұрыштық жылдамдықпен айналса күміс атомдары, айналу бағытына қарама-қарсы бағытта, саңлаудың экрандағы кескінінен  шамаға ығысады. Себебі, шоқтағы өз инерциясымен қозғалған бөлшектер R – r аралықты үшып өтетін t уақытта, құрал
шамаға ығысады. Себебі, шоқтағы өз инерциясымен қозғалған бөлшектер R – r аралықты үшып өтетін t уақытта, құрал 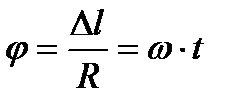 бұрышқа бұрылып үлгереді. Осыдан,
бұрышқа бұрылып үлгереді. Осыдан, 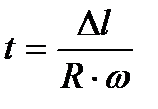 екендігін ескеріп, күміс атомдарының орташа жылдамдығын анықтайтын формуланы мына түрде жазуға болады:
екендігін ескеріп, күміс атомдарының орташа жылдамдығын анықтайтын формуланы мына түрде жазуға болады:


Тәжірбиеде экранда қонған атомдардың  бойымен таралып орналасуы байқалған. Бұл баяу атомдардың ығысуы шапшаң атомдарға қарағанда артық болатынмен түсіндірілді. Экрандағы қонбаның әр жеріндегі қалыңдықтарын өлшеу арқылы молекулалардың жылдамдықтары бойынша таралу заңдылығын тағайындауға болады. Себебі, қонбаның әр нүктесіндегі қалыңдығы белгілі-бір жылдамдыққа ие молекулалар санына пропорционал.
бойымен таралып орналасуы байқалған. Бұл баяу атомдардың ығысуы шапшаң атомдарға қарағанда артық болатынмен түсіндірілді. Экрандағы қонбаның әр жеріндегі қалыңдықтарын өлшеу арқылы молекулалардың жылдамдықтары бойынша таралу заңдылығын тағайындауға болады. Себебі, қонбаның әр нүктесіндегі қалыңдығы белгілі-бір жылдамдыққа ие молекулалар санына пропорционал.
Сымнан өтетін ток күшінің өзгерісі молекулалар пайда болатын беттің температурасын өзгертеді, ал ол молекулалар жылдамдығының температураға байланыстылығын зерттеуге мүмкіндік береді. Штерн тәжірбиесінен күміс молекулаларының орташа жылдамдығы түбір астындағы абсолют температураға тура пропорционал екендігі дәлелденген, яғни, 


Билет.
Менделеев-Клапейрон теңдеуі.Газдың біріктірілген заңы.
Менделеев-Клапейрон теңдеуі – идеал газдың күйін анықтайтын және оның негізгі параметрлерін (Р-қысымның,V- молярлық көлемнің,Т-абсалют температураның) арасындағы байланысты тағайындайтын теңдеу. (1)  қысым,
қысым,  -молярлық көлем,R-универсал газ тұрақтысы,Т-абсалют температура.
-молярлық көлем,R-универсал газ тұрақтысы,Т-абсалют температура.
(2) 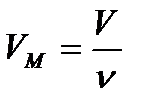 ;(3)
;(3) 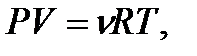 так как (4)
так как (4)  ;теңдеу мына түрге келеди (5)
;теңдеу мына түрге келеди (5)  -бұл теңдеу m-масса үшін идеал газ күйінің теңдеуі немесе Менделеев-Клапейрон теңдеуі деп аталады.
-бұл теңдеу m-масса үшін идеал газ күйінің теңдеуі немесе Менделеев-Клапейрон теңдеуі деп аталады. 
 екенін біле отырып біз (5) теңдеуді мына түрде жаза аламыз
екенін біле отырып біз (5) теңдеуді мына түрде жаза аламыз
 ;
; 
 бұл жердегі К-больцман тұрақтысы,N-молекулалар саны,n-молекулалар шоғыры(концентрациясы)
бұл жердегі К-больцман тұрақтысы,N-молекулалар саны,n-молекулалар шоғыры(концентрациясы)
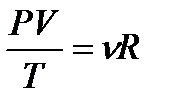 -тұрақты масса кезінде теңдеуді
-тұрақты масса кезінде теңдеуді 

 Клапейрон теңдеуі немесе Газдың біріктірілген заңы деп аталады.
Клапейрон теңдеуі немесе Газдың біріктірілген заңы деп аталады.
Билет.
Барометрлік формула. Больцман таралуы.
Молекулалардын, хаостық қозғалысының арқасында газ бөлшектері ыдыстың көлемінде біркелкі таралады, сөйтіп ыдыстың көлемінің әрбір бірлігінде орташа есеппен бөлшектердің бірдей саны болады. Тепе-тендік күйде газдың кысымы мен температурасы да көлемнің өне бойында бірдей болады. Бірақ мүндай жағдай, тек сыртқы күштер әсер етпейтін кезде ғана болады. Сыртқы күштер бар кезде молекулалардын қозғалысы газға басқа сипат береді.
Ph=P0 e-Mgh/kT
Кысымнын биіктікке тәуелді түрде өшетінін көрсететін өрнек барометрлік өрнек деп аталады. Осы өрнектен көріп отырғанымыздай, газ қысымы биіктікке байланысты экспонента түрінде азаяды екен.
P қысымын nkT арқылы, ал M/R–ді m/k- мен алмастырып, кез келген күштің потенциал өрісінде бөлшектердің биіктік бойынша, сонымен қатар олардың потенциалдық энергияларының мәндері бойынша таралу заңын (Больцманның таралу заңын) анықтаймыз:
n=n0 e-Mgh/RT = n0 e-mgh/RT = n0 e- E /kT
мұндағы n0 –биіктігі нольге тең бірлік көлемдегі бөлшектер саны, ал n-h биіктіктегі дәл сондай сан. Бұл формуладан потенциалдық энергиясы аз болатын жерлерде бөлшектердің тығыз орналасып, ал потенциалдық энергиясы көп болатын жерлерде сирегірек орналасатындығы шығады. Т=const болғанда молекулалардың еркін жолының ұзындығы қысымға кері пропорционал болатынын көреміз.Газ тепе-теңдік күйде болғанда оның температурасы мен қысымы көлемнің кез-келген нүктесінде тұрақты болады.
Билет.
Газ заңдары.Изопроцестер
Газ заңдары.
Газ тәріздес күйдегі заттың жеке меншік V болмайды. Ыдысқа толтырылған газ оның толық көлемін алады. Сондай-ақ, газ әр қашан ыдыс қаб-на Р түсіреді. 17ғ ортасында Р.Бойль және Э.Мариотт бір біріне Т=const кезіндегі газдың Р мен V байланыстың заң ашты.

|
| 1.10-сурет |
Параметрлерiнiң бiрiнiң шамасы өзгерiссiз өтетiн процестердi изопроцестер деп атайды. Газдың үшiншi параметрi тұрақты болған кездегi екi параметрi арасындағы мөлшерлiк байланысты (тәуелдiлiктi) газ заңдары деп атайды.
Идеал газ күйiнiң теңдеуiне сүйенiп изопроцестердiң негiзгi түрлерiнiң физикалық құбылыстарын қарастырайық.
Температура тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изотермиялық процесс деп атайды. Бұл процесс Бойль - Мариотт заңмен жазылады:
PV = const
Газ температурасын тұрақты ұстау үшiн, оның температурасын өзгертпейтiндей етiп жылуалмасып тұратын жүйе – термостат қажет. Әйтпесе, газ сығылғанда немесе созылғанда оның температурасының өзгерiсi елеулi.Изотермиялық процестiң (P,V) жазықтығындағы графигi, мзотерма деп аталатын, гиперболаны бередi (1.10 - сурет).

|
| 1.11-сурет |
Қысым тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изобаралық процесс деп атайды. Егер ыдыста газ қысымы тұрақты болуы үшiн, оның қабырғалары жылжымалы (қозғалмалы) болуы керек. Изобаралық процестiң (V,Т) жазықтығындағы графигi, мзобара деп аталатын, түзу сызықты бередi (1.11 - сурет).

|
| 1.12-сурет |
Көлем тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изохоралық процесс деп атайды. Егер газ герметикалық ыдыста болса, онда газ көлемi тұрақты болады. Изохоралық процестiң (P,T) жазықтығындағы графигi, мзохора деп аталатын, түзу сызықты бередi (1.12 - сурет).
Билет.
Концентрация түсінігі. Қысым. Парциал қысым. Дальтон заңы.
Концентрация түсінігі. Қоспа(ерітінді,қорытпа)кұрамындағы затты компонент д.а.Қоспаның қосылыс сандық кұрамын әр түрлі тәсілдер арқ. анық.Қоспаның бірлік массасындағы не бірлік колеміндегі зат компонентерінің мөлшерін концентрация д а.ол % аныкт.ρ=m\V кг/м3 n=N/V 1/ м3 Қысым - бір дене екінші дене бетіне әсер еткенде пайда болатын қалыпты күштің (дене бетіне перпендикуляр) қарқындылығын сипаттайтын физикалық шама. Егер денеге әсер ететін күш оның бетіне біркелкі таралса, онда қысым (р) былай өрнектеледі: P=F/A не P=dF/dA Мұндағы S – дене бетінің күш түсетін бөлігінің ауданы, F – сол бөлікке перпендикуляр түсірілген күштердің қосындысы. Күш біркелкі таралған жағдайда қысым дене бетінің барлық нүктесінде бірдей болады, ал күш біркелкі таралмаса, онда қысым бір нүктеден екінші нүктеге өткен сайын өзгеріп отырады. Тыныштықтағы сұйықтықтың кез келген нүктесінің барлық бағытындағы қысымы бірдей болады. Бұл жағдай қозғалыстағы идеал (үйкеліссіз қозғалатыс) сұйық пен газ үшін де орындалады. Тұтқыр сұйықтықтың берілген нүктедегі қысымы ретінде өзара перпендикуляр үш бағыттағы (х, у, z – осьтері бағытындағы) қысымның орташа мәні р = (рх+ру+рz)/3 алынады. Газдардың кинетикалық теориясы бойынша, газды ортадағы қысым жылулық қозғалыстағы газ молекулаларының бір-бірімен, газдағы денелермен және ыдыс қабырғаларымен соқтығысуы кезінде импульстың берілуімен байланысты болғандықтан мұны “жылулық” қысым деп атайды. Ол газдың абсолют температурасы (Т) мен бірлік көлемдегі газ молекулаларының санына (n) пропорционал: р = nkT, мұндағы k = 1,38.10–23 Дж/К – Больцман тұрақтысы.
Парциал қысым. Дальтон заңы.. Ыдыста бірнеше газ қоспасы болсын ж/е олардың мол.концент-сы n1,n2…ni онда мол-н жалпы концен n= n1+ n2+..+ ni=Ʃi ni.Газ қоспасының ыдыс қабырғасына түсіретін қысымы: P=nkT= n1 kT+ n2 kT+… ni kT P1=n1 kT P2=n2 kT –парциал қысымдар деп ат. Мыс P1=n1 kT- қоспаға кіретін 1-газдың парц кысымы.Берілген газдың парциал қысымы деп-ол алғашында қандай мөлшерде болса,сондай мөлшерде жалгыз өзі болып,ыдыс қабырғасына түсіретін қысымын айтады.. P= P1+ P2+…+=Ʃ Pi-----Дальтон заңы.
Билет.
Температура. Температураның абсолюттік шкаласы. Температураның орташа кинетикалық энергиямен байланысы
Температура - хаосты жылулық қозғалыстың макроскопиялық сипаттамасы,сондай-ақ жылудың денеде сақталуының корсеткіші,өлшемі.Техникада және күнделікті өмірде температураны өлшеу үшін Цельсия ( )шкаласы қолданылады. Ал физикада абсалюттік температуралық (
)шкаласы қолданылады. Ал физикада абсалюттік температуралық ( ) шкаланы қолданған ыңғайлы.
) шкаланы қолданған ыңғайлы.  -абсалюттік температураның
-абсалюттік температураның  -Цельсия шкаласы бойынша алынған температуаның байланысын мына қатынаспен көруге болады:
-Цельсия шкаласы бойынша алынған температуаның байланысын мына қатынаспен көруге болады: 
Абсалюттік температураның өлшем бірлігі Кельвин д аталады( ) ал халықаралық практикалық температураны Цельсия градусында өлшейді.(
) ал халықаралық практикалық температураны Цельсия градусында өлшейді.( еп).
еп).  температураны абсалюттік ноль деп атайды.
температураны абсалюттік ноль деп атайды. 
 Ал енди абсалюттік температура мен молекуланың орташа кинетикалық энергиясының арасындағы байланысты қарастырайық.
Ал енди абсалюттік температура мен молекуланың орташа кинетикалық энергиясының арасындағы байланысты қарастырайық.
(1)  -бұл молекула-кинетикалық теорияның негізгі теңдеуі.Теңдеудің аламында бөлімінде
-бұл молекула-кинетикалық теорияның негізгі теңдеуі.Теңдеудің аламында бөлімінде 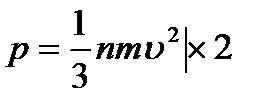 көбейтейік
көбейтейік 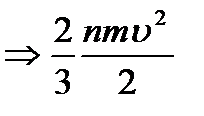 (2) бұл жердегі
(2) бұл жердегі  -бір молекуланың ілгермелі қозғалысының орташа кинетикалық энергиясы.Сонда біздің (2) теңдеуіміз мына түрге келеді
-бір молекуланың ілгермелі қозғалысының орташа кинетикалық энергиясы.Сонда біздің (2) теңдеуіміз мына түрге келеді  (3)біз білеміз (4)
(3)біз білеміз (4)  қысым мен абсалют температураны байланыстыратын идеал газ күйінің теңдеуі.(3) және (4) теңдеуді теңестіре отырып
қысым мен абсалют температураны байланыстыратын идеал газ күйінің теңдеуі.(3) және (4) теңдеуді теңестіре отырып
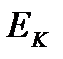 -ны табатын болсақ
-ны табатын болсақ  міне енди біз осы теңдік арқылы біз өте маңызды қорытындыға келдик, молекуланың абсалюттік температурасы бір молекуланың ілгермелі қозғаласының орташа кинетикалық энергиясына тура пропорционал.
міне енди біз осы теңдік арқылы біз өте маңызды қорытындыға келдик, молекуланың абсалюттік температурасы бір молекуланың ілгермелі қозғаласының орташа кинетикалық энергиясына тура пропорционал.
Билет.
Идеал газ үлгісі. Газдардың молекула кинетикалық теориясының негізгі теңдеуі
Билет.
Зат мөлшері - моль. Молярлық масса. Авогадро саны.
Әртүрлi денелер молекуласының масса бiрлiгi ретiнде 12С көмiртегi изотобы атомының moc массасының 1/12 бөлiгi алынады. Ол атомдық масса бiрлiгi (а.м.б.) деп аталады және мынаған тең: 1 а.м.б. =1,66·10-27 кг. (1.1) Заттың салыстырмалы молекулалық массасы МR деп заттың бiр молекула m0 массасының көмiртегi атомы moc массасының 1/12 бөлiгiне қатынасын айтады: 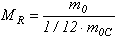 (1.2)
(1.2)
Зат мөлшерi деп берiлген жүйенiң бөлшектерiнiң, құрылымдық элементерiнiң, санына пропорционал ν шаманы айтады. Оны моль арқылы жазу қабылданған. Массасы 0,012 кг 12С көмiртегiнде қанша атом болса, сонша молекуладан (атомнан) тұратын зат мөлшерi бiр моль деп аталады. Бұл сан Авогадро тұрақтысы деп аталады және NA арқылы белгiленедi:
NA ≈ 6·1023 моль-1. (1.3)
Сәйкесiнше, кез келген заттың 1 молiнде атомдар саны мен молекулалар саны бiрдей болады. Егер денедегi зат мөлшерi ν мольден тұрса, онда денедегi молекулалар N саны мынаған тең:
N = ν · NA. (1.4)
Заттың молярлық массасы М деп бiр моль мөлшерiнде алынған зат массасын айтады. Ол бiр молекула массасының m0 Авогадро санына NA көбейтiндiсiне тең:
М = m0· NA кг/моль. (1.5)
Молярлық және молекулалық массалар арасында мынадай қарапайым байланыс бар:
М = 10-3 ·Мr кг/моль. (1.6)
Кез келген зат мөлшерiнiң m массасы бiр молекуланың массасын денедегi молекулалар санына көбейткенге тең:
Не нашли, что искали? Воспользуйтесь поиском: